题目内容
【题目】汽车等机动车尾气,含(CO、NO等)是城市空气的污染源。利用NSR技术可有效降低CO、NO的排放,回答有关问题:
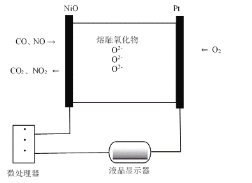
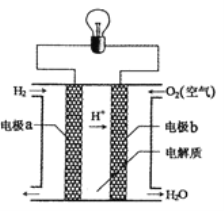
I.CO、NO的检测
(1)O2-的移动方向为__________。(填“向Pt电极”或“向NiO电极”)
(2)NiO电极上的电极反应为___________和__________。
II.NSR处理技术
NO的储存和还原在不同时段交替进行,实现两种有害气体,同时被处理,工作如图所示。
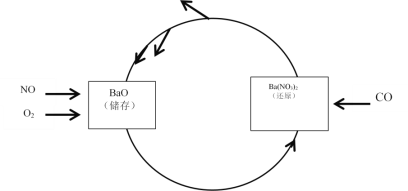
(3)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol ①
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol ②
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g)③的ΔH=________
(4)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO,发生反应,反应过程中c(NO)随时间的变化曲线如图所示。
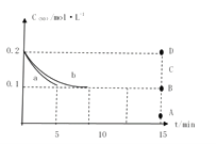
①图中曲线a或b中表示在该温度下使用NSR催化技术的是__________。
②曲线b中前10min内CO的平均反应速率v(CO)=_________;此温度下该反应的平衡常数K为_______。若平衡后,再向容器中充入CO和N2各0.8mol,则此时v(正)_____ v(逆)(填“>”、“<”或“=”)。
③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是____点。(填字母)
【答案】向NiO电极 CO+O2--2e-=CO2 NO+O2--2e-=NO2 -746.5kJ/mol a 0.01molL-1·min-1 5 > C
【解析】
I.由装置图可知,该装置为原电池装置,通入CO、NO的一极,产物为CO2、NO2,C、N元素化合价升高,失电子,发生氧化反应,则NiO电极为负极,通入氧气的一极为正极,Pt电极为正极,
(1)在原电池中阴离子移动向正极;
(2)NiO电极通入CO、NO,产物为CO2、NO2,电解质环境为熔融氧化物,用O2-配平电极反应式的电荷守恒;
II.(3)根据已知的热化学方程式和盖斯定律进行计算;
(4)①催化剂可以加快反应速率,缩短到达平衡的时间;
②根据公式![]() 计算反应速率;根据已知信息列出三段式计算平衡常数;根据此时的浓度商与平衡常数的大小关系判断反应进行的方向,从而确定正逆反应速率的大小关系;
计算反应速率;根据已知信息列出三段式计算平衡常数;根据此时的浓度商与平衡常数的大小关系判断反应进行的方向,从而确定正逆反应速率的大小关系;
③根据压强对物质浓度以及平衡移动的影响分析。
I.由装置图可知,该装置为原电池装置,通入CO、NO的一极,产物为CO2、NO2,C、N元素化合价升高,失电子,发生氧化反应,则NiO电极为负极,通入氧气的一极为正极,Pt电极为正极,
(1)经分析知,NiO电极为负极,Pt电极为正极,在原电池中阴离子移动向正极,则O2-的移动方向NiO电极;
故答案为:向NiO电极;
(2)NiO电极通入CO、NO,产物为CO2、NO2,电解质环境为熔融氧化物,用O2-配平电极反应式的电荷守恒,则电极反应为CO+O2--2e-=CO2和NO+O2--2e-=NO2;
故答案为:CO+O2--2e-=CO2;NO+O2--2e-=NO2;
II.(3)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol ①
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol ②,根据盖斯定律可知目标方程
2CO(g)+2NO(g)=N2(g)+2CO2(g) ③=②-①,则ΔH=-566.0 kJ/mol-180.5 kJ/mol=-746.5kJ/mol;
故答案为:-746.5kJ/mol;
(4)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO,发生反应2CO(g)+2NO(g)=N2(g)+2CO2(g),
①催化剂可以加快反应速率,缩短到达平衡的时间,图中曲线a先到达平衡状态,则表示在该温度下使用NSR催化技术的是曲线a;
故答案为:a;
②曲线b中前10min内CO的浓度变化量为0.2mol/L-0.1mol/L=0.1 mol/L,则CO平均反应速率![]() ;根据已知信息起始NO和CO的物质的量相等,可列出三段式:
;根据已知信息起始NO和CO的物质的量相等,可列出三段式:
2CO(g)+2NO(g)=N2(g)+2CO2(g)
开始(mol/L):0.2 0.2 0 0
变化(mol/L):0.1 0.1 0.05 0.1
平衡(mol/L):0.1 0.1 0.05 0.1
则此温度下该反应的平衡常数![]() ;若平衡后,再向容器中充入CO和N2各0.8mol,此时c(CO)=0.5mol/L ,c(NO)=0.1 mol/L,c(N2)=0.45 mol/L,c(CO2)=0.1 mol/L,此时的浓度商为
;若平衡后,再向容器中充入CO和N2各0.8mol,此时c(CO)=0.5mol/L ,c(NO)=0.1 mol/L,c(N2)=0.45 mol/L,c(CO2)=0.1 mol/L,此时的浓度商为![]() ,则反应正向进行,v(正)> v(逆);
,则反应正向进行,v(正)> v(逆);
故答案为:0.01molL-1·min-1;5;>;
③15min时反应处于平衡状态,若保持其他条件不变,此时将容器的体积压缩至1L,各物质的浓度瞬间加倍,NO的物质的量浓度立即变为0.2 molL-1,此时压强增大,平衡正向移动,NO的浓度又逐渐减小,根据勒夏特列原理可知,平衡移动的结果只是减弱这种改变,而不是消除,因此20min时反应重新达到平衡,NO的物质的量浓度范围为0.1 mol/L <c(NO)<0.2 mol/L,对应的点可能是C点;
故答案为:C。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案