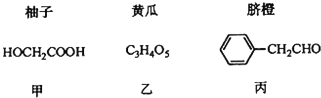
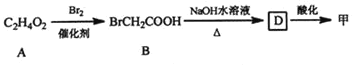
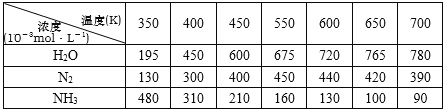
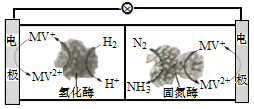
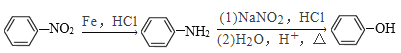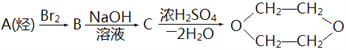题目内容
【题目】四种短周期主族元素 X、Y、Z、W 的相对位置如表,元素 X 的原子核外电子数是 Z的 2 倍。下列说法不正确的是
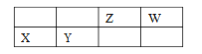
A. W 元素的简单气态氢化物的热稳定性比 Z 元素的简 单气态氢化物的高
B. 气体分子(ZW)2 的结构式为 N≡C—C≡N
C. X、Y、W 三种元素的简单离子半径最大的是 Y
D. 元素 X 位于周期表中第三周期、第ⅡA族,其单质制备可用电解熔融 XCl2 的方法。
【答案】C
【解析】元素X的原子核外电子数是Z的2倍,假设Z的核外电子数为x,则X为x+8-2,因此x+8-2=2x,解得x=6,则X为Mg,Y为Al,Z为C,W为N。A. 元素的非金属性越强,简单气态氢化物越稳定,W元素的简单气态氢化物的热稳定性比Z元素的简单气态氢化物的高,故A正确;B. 根据8电子稳定结构,N原子需要形成3个共用电子对,C原子需要形成4个共用电子对, (CN)2的结构式为N≡C—C≡N,故B正确;C. X、Y、W三种元素的简单离子具有相同的电子层结构,核电荷数越大,离子半径越小,半径最大的是W,故C错误;D. 镁为12号元素,位于周期表中第三周期、第ⅡA族,工业上常用电解熔融的氯化镁的方法冶炼金属镁,故D正确;故选C。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】A、B、C、D、E、F、G、H 是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有 6 种不同运动状态的电子 |
C | 基态原子中 s 电子总数与p 电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为 3s23p1 |
F | 基态原子的最外层 p 轨道有两个电子的自旋方向与其他电子的自 旋方向相反 |
G | 基态原子核外有 7 个能级且能量最高的能级上有 6 个电子 |
H | 是我国使用最早的合金中的最主要金属元素 |
(1) A 元素的名称是_______________;A 元素和 F 元素形成的最简单化合物的分子构型为_______________,该分子是_______________分子。(填“极性”或“非极性”)
(2) B 元素形成的单质分子中σ键与π键数目之比为_______________。
(3) G 元素的低价阳离子的离子结构示意图是_______________。
(4) G 的高价阳离子的溶液与 H 单质反应的离子方程式为___________________________________