题目内容
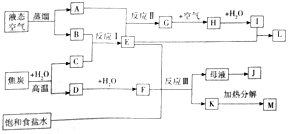
【题目】如图是某大型化工生产的工艺流程图![]() 部分反应物或生成物已经略去
部分反应物或生成物已经略去![]() :
:
请回答下列问题:
![]() 流程中所涉及的化学工业有:合成氨、 ______ 联合制碱法
流程中所涉及的化学工业有:合成氨、 ______ 联合制碱法![]() 或侯式制碱法
或侯式制碱法![]() .
.
![]() 工业从液态空气中分离出A、B利用的原理是 ______ .
工业从液态空气中分离出A、B利用的原理是 ______ .
![]() 图示中G生成H的流程中为了提高原料的利用率和减少污染,生产中往往采取的操作是 ______ .
图示中G生成H的流程中为了提高原料的利用率和减少污染,生产中往往采取的操作是 ______ .
![]() 工业生产反应Ⅰ的方程式为 ______ ,为提高原料转化率的反应条件是 ______ ,生产中需将产物液化分离的目的是 ______ .
工业生产反应Ⅰ的方程式为 ______ ,为提高原料转化率的反应条件是 ______ ,生产中需将产物液化分离的目的是 ______ .
![]() 写出反应Ⅱ的化学方程式 ______ .
写出反应Ⅱ的化学方程式 ______ .
![]() 图示中生成小苏打的化学方程式 ______ ,母液与K分离的方法是 ______
图示中生成小苏打的化学方程式 ______ ,母液与K分离的方法是 ______ ![]() 有两种方案从母液中获得副产品J:
有两种方案从母液中获得副产品J:![]() 通入氨气、冷却、加食盐、过滤
通入氨气、冷却、加食盐、过滤![]() 不通氨气、冷却、加食盐、过滤对比这两种方案.方案
不通氨气、冷却、加食盐、过滤对比这两种方案.方案![]() 通入氨气的作用 ______ ;方案
通入氨气的作用 ______ ;方案![]() 滤液一般不能反复循环利用,其原因是 ______ .
滤液一般不能反复循环利用,其原因是 ______ .
【答案】硝酸制备 根据沸点不同进行分离 通入过量的空气,一氧化氮循环使用 ![]() 高压 降低生成物浓度,使平衡正向移动,提高原料的利用率
高压 降低生成物浓度,使平衡正向移动,提高原料的利用率 ![]()
![]() 饱和
饱和![]() 过滤 增加铵根离子浓度有利于析出氯化铵晶体,降低碳酸氢根离子浓度,析出的氯化铵较纯 滤液中碳酸根离子浓度增大,最终影响副产品的纯度
过滤 增加铵根离子浓度有利于析出氯化铵晶体,降低碳酸氢根离子浓度,析出的氯化铵较纯 滤液中碳酸根离子浓度增大,最终影响副产品的纯度
【解析】
流程分析可知,液态空气蒸馏得到A、B为![]() 和
和![]() ,焦炭和水高温反应生成C、D为
,焦炭和水高温反应生成C、D为![]() 和CO,B和C能反应生成E,是工业生产中的反应,则应为合成氨的反应,则E为
和CO,B和C能反应生成E,是工业生产中的反应,则应为合成氨的反应,则E为![]() ,进一步推得A为
,进一步推得A为![]() ,B为
,B为![]() ,C为
,C为![]() ,D为CO,CO和
,D为CO,CO和![]() 反应生成氢气和二氧化碳,所以F为
反应生成氢气和二氧化碳,所以F为![]() ,
,![]() ,是氨气和氧气反应生成一氧化氮和水,G为NO,H为
,是氨气和氧气反应生成一氧化氮和水,G为NO,H为![]() ,I为
,I为![]() ,硝酸和氨气反应生成L是
,硝酸和氨气反应生成L是![]() ,氨气、二氧化碳和饱和氯化钠溶液反应生成碳酸氢钠沉淀和氯化铵,所以K为
,氨气、二氧化碳和饱和氯化钠溶液反应生成碳酸氢钠沉淀和氯化铵,所以K为![]() ,M为
,M为![]() ,母液为
,母液为![]() ,加入氯化钠析出氯化铵晶体J,据此答题。
,加入氯化钠析出氯化铵晶体J,据此答题。
流程分析可知,液态空气蒸馏得到A、B为![]() 和
和![]() ,焦炭和水高温反应生成C、D为
,焦炭和水高温反应生成C、D为![]() 和CO,B和C能反应生成E,是工业生产中的反应,则应为合成氨的反应,则E为
和CO,B和C能反应生成E,是工业生产中的反应,则应为合成氨的反应,则E为![]() ,进一步推得A为
,进一步推得A为![]() ,B为
,B为![]() ,C为
,C为![]() ,D为CO,CO和
,D为CO,CO和![]() 反应生成氢气和二氧化碳,所以F为
反应生成氢气和二氧化碳,所以F为![]() ,
,![]() ,是氨气和氧气反应生成一氧化氮和水,G为NO,H为
,是氨气和氧气反应生成一氧化氮和水,G为NO,H为![]() ,I为
,I为![]() ,硝酸和氨气反应生成L是
,硝酸和氨气反应生成L是![]() ,氨气、二氧化碳和饱和氯化钠溶液反应生成碳酸氢钠沉淀和氯化铵,所以K为
,氨气、二氧化碳和饱和氯化钠溶液反应生成碳酸氢钠沉淀和氯化铵,所以K为![]() ,M为
,M为![]() ,母液为
,母液为![]() ,加入氯化钠析出氯化铵晶体J;
,加入氯化钠析出氯化铵晶体J;
![]() 流程中设计到的工业制备有工业合成氨、硝酸制备,联合制碱;
流程中设计到的工业制备有工业合成氨、硝酸制备,联合制碱;
![]() 利用氮气和氧气的沸点不同通过蒸馏方法控制温度分离得到氮气和氧气;
利用氮气和氧气的沸点不同通过蒸馏方法控制温度分离得到氮气和氧气;
![]() 通入过量的空气,过程中生成的一氧化氮循环使用,可以提高一氧化氮的利用率和减少污染;
通入过量的空气,过程中生成的一氧化氮循环使用,可以提高一氧化氮的利用率和减少污染;
![]() 工业生产反应Ⅰ是氮气和氢气高温高压催化剂反应生成氨气,反应方程式为:
工业生产反应Ⅰ是氮气和氢气高温高压催化剂反应生成氨气,反应方程式为:![]() ,提高原料转化率,应使平衡正向进行,可以增大压强,所以提高原料转化率的反应条件是高压,生产中需将产物液化分离可以降低生成物浓度,使平衡正向移动,提高原料的利用率;
,提高原料转化率,应使平衡正向进行,可以增大压强,所以提高原料转化率的反应条件是高压,生产中需将产物液化分离可以降低生成物浓度,使平衡正向移动,提高原料的利用率;
![]() 反应Ⅱ是氨气的催化氧化反应生成一氧化氮和水,反应方程式为
反应Ⅱ是氨气的催化氧化反应生成一氧化氮和水,反应方程式为![]() ;
;
![]() 是向氨化的饱和食盐水中通入二氧化碳气体发生反应生成碳酸氢钠和氯化铵,反应方程式为
是向氨化的饱和食盐水中通入二氧化碳气体发生反应生成碳酸氢钠和氯化铵,反应方程式为![]() 饱和
饱和![]() ,母液与碳酸氢钠分离的方法是过滤,从母液中获得副产品
,母液与碳酸氢钠分离的方法是过滤,从母液中获得副产品![]() :通入氨气、冷却、加食盐、过滤,通入氨气的作用是增加铵根离子浓度有利于析出氯化铵晶体,降低碳酸氢根离子浓度,析出的氯化铵较纯,由于滤液中碳酸根离子浓度增大,最终影响副产品的纯度,所以滤液一般不能反复循环利用。
:通入氨气、冷却、加食盐、过滤,通入氨气的作用是增加铵根离子浓度有利于析出氯化铵晶体,降低碳酸氢根离子浓度,析出的氯化铵较纯,由于滤液中碳酸根离子浓度增大,最终影响副产品的纯度,所以滤液一般不能反复循环利用。

【题目】四氯化锡![]() 是一种重要的化工产品。某兴趣小组拟制备四氯化锡。
是一种重要的化工产品。某兴趣小组拟制备四氯化锡。
I.(查阅资料)
物质 | 熔点 | 沸点 | 化学性质 |
Sn | 231 | 227 | 加热时与 |
| 246 | 652 |
|
|
| 114 | 极易水解 |
Ⅱ![]() (制备产品)
(制备产品)
实验装置如图所示![]() 省略夹持和加热装置
省略夹持和加热装置![]()
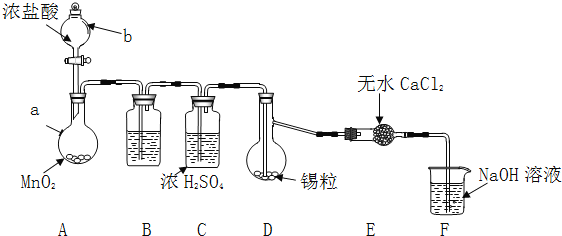
实验步骤:
(1)检查装置气密性后,按图示加入试剂.仪器b的名称是 ______ ,其中无水![]() 的作用是 ______ ,B中的试剂是 ______
的作用是 ______ ,B中的试剂是 ______ ![]() 选填下列字母编号
选填下列字母编号![]() 。
。
A.![]() 溶液
溶液 ![]() 溶液
溶液
![]() 饱和NaCl溶液
饱和NaCl溶液 ![]() 溶液
溶液
(2)先向A中烧瓶内加入盐酸并加热a,当整个装置 ______ 后![]() 填实验现象
填实验现象![]() ,再加热熔化锡粒,反应完后,停止加热。
,再加热熔化锡粒,反应完后,停止加热。
(3)待反应结束后,经 ______ ![]() 填写操作名称
填写操作名称![]() 、洗涤、干燥,可回收利用装置A中未反应完的
、洗涤、干燥,可回收利用装置A中未反应完的![]() 。
。
Ⅲ![]() 探究与反思
探究与反思![]()
(1)装置F中吸收![]() 发生反应的离子方程式是 ______ 。
发生反应的离子方程式是 ______ 。
(2)实验在D中得到的产品很少,经分析装置设计有缺陷,应在D和E之间补充 ______ ![]() 填装置名称
填装置名称![]() 。
。
(3)为验证产品中是否含有![]() ,该小组设计了以下实验方案:
,该小组设计了以下实验方案:![]() 所需试剂从稀
所需试剂从稀![]() 、稀HCl、
、稀HCl、![]() 溶液、
溶液、![]() 溶液、KSCN溶液、蒸馏水中选择
溶液、KSCN溶液、蒸馏水中选择![]()
取适量![]() 产品溶入20mL蒸馏水中,加入 ______ ,若 ______
产品溶入20mL蒸馏水中,加入 ______ ,若 ______ ![]() 填实验现象
填实验现象![]() ,则含有
,则含有![]() ,否则无
,否则无![]() 。
。
【题目】A、B、C、D、E、F、G、H 是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有 6 种不同运动状态的电子 |
C | 基态原子中 s 电子总数与p 电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为 3s23p1 |
F | 基态原子的最外层 p 轨道有两个电子的自旋方向与其他电子的自 旋方向相反 |
G | 基态原子核外有 7 个能级且能量最高的能级上有 6 个电子 |
H | 是我国使用最早的合金中的最主要金属元素 |
(1) A 元素的名称是_______________;A 元素和 F 元素形成的最简单化合物的分子构型为_______________,该分子是_______________分子。(填“极性”或“非极性”)
(2) B 元素形成的单质分子中σ键与π键数目之比为_______________。
(3) G 元素的低价阳离子的离子结构示意图是_______________。
(4) G 的高价阳离子的溶液与 H 单质反应的离子方程式为___________________________________