题目内容
4.2008年9月国家有关部门检出了以三鹿婴幼儿奶粉为首的一批奶制品中掺和的三聚氰胺,并立即对全国的这些奶制品加以封存或销毁.三聚氰胺本是一种优良的化工原料,主要用来制涂料和黏合剂,它的相对分子质量介于100与200之间,碳的质量分数为28.57%,碳、氢的质量比为6:1,其余为氮.则三聚氰胺的分子式为( )| A. | (CH2N2)n | B. | C3H4ON5 | C. | C3H6N6 | D. | C4H4N5 |
分析 结合碳元素质量分数与C、H质量之比计算H元素质量分数,进而计算N元素质量分数,根据n=mMmM计算C、H、N原子数目之比,进而确定最简式,再结合相对分子质量确定化学式.
解答 解:碳的质量分数为28.57%,碳、氢的质量比为6:1,则H元素质量分数为28.57%÷6=4.76%,故N元素质量分数为1-28.57%-4.76%=66.67%,故C、H、N原子数目之比为28.571228.5712:4.7614.761:66.671466.6714=1:2:2,故三聚氰胺的最简式为CH2N2,令分子式为(CH2N2)x,相对分子质量介于100与200之间,则100<42x<200,故x=3或4,结合选项可知,三聚氰胺的分子式为C3H6N6,故选C.
点评 本题考查有机物分子式确定有关计算,难度不大,关键是确定最简式,注意结合选项判断.

练习册系列答案
相关题目
14.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O△→△→2C6H5OH+CO32- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-△→△→CO32-+2NH4++4Ag↓+6NH3+2H2O |
15.天然气是一种多组分的化石燃料.其主要成分是( )
| A. | 甲烷 | B. | 氮气 | C. | 氢气 | D. | 氧气 |
12.把纯碘化氢气体装入密闭容器中,它将按2HI?H2+I2反应进行分解(正反应吸热),当系统在趋向平衡状态的过程中,以下描述正确的是( )
| A. | 碘化氢的生成速率大于其分解速率 | |
| B. | 碘化氢的生成速率等于其分解速率 | |
| C. | 加催化剂不会影响达到平衡的时间 | |
| D. | 升高温度可以缩短到达平衡状态的时间 |
9.短周期主族元素A、B、C、D,原子序数依次增大.A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:C>A | |
| C. | 最高价氧化物对应水化物的酸性:D>C | |
| D. | 单质B常温下能溶于浓硝酸 |
16.25℃时,物质的量浓度均为0.01mol•L-1 的HA和BOH溶液,pH分别为3和12,将物质的量浓度相等两溶液等体积混合后,所得溶液的pH( )
| A. | 可能等于7 | B. | 一定<7 | C. | 一定>7 | D. | 无法判断 |
14.与NH4+互为等电子体的微粒是( )
| A. | H3O+ | B. | OH- | C. | NH3 | D. | CH4 |

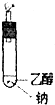 乙醇(C2H5OH)是一种重要的有机物.
乙醇(C2H5OH)是一种重要的有机物.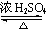 CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式
CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式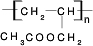 .
.