题目内容
9.短周期主族元素A、B、C、D,原子序数依次增大.A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )| A. | 原子半径:A<B<C<D | |
| B. | 非金属性:C>A | |
| C. | 最高价氧化物对应水化物的酸性:D>C | |
| D. | 单质B常温下能溶于浓硝酸 |
分析 短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A、C的原子序数的差为8,则A、C为同主族元素,令B原子最外层电子数为x,则A、C的最外层电子数为2x,A、B、C三种元素原子的最外层电子数之和为15,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素,据此解答.
解答 解:短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A、C的原子序数的差为8,则A、C为同主族元素,令B原子最外层电子数为x,则A、C的最外层电子数为2x,A、B、C三种元素原子的最外层电子数之和为15,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素.
A.同周期随原子序数增大原子半径减小,电子层越多原子半径越大,故原子半径O<Cl<S<Al,故A错误;
B.同主族自上而下非金属性减弱,故非金属性C<A,故B错误;
C.非金属性D(Cl)>C(S),故最高价氧化物对应水化物的酸性:D>C,故C正确;
D.常温下Al在浓硝酸中发生钝化现象,不能溶解,故D错误,
故选:C.
点评 本题考查结构位置性质关系,难度中等,关键是利用奇偶性及A、C的原子序数相差8判断二者处于同一主族(短周期),注意短周期中原子序数相差8不一定为同主族,如H与F.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.关于溶液中微粒的浓度,下列说法正确的是( )
| A. | 0.1mol•L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 等浓度等体积的NaHSO3溶液与NaClO溶液混合后:c(Na++c(H+)═c(HSO3-)+c(ClO-)+2c(SO32-)+c(OH-) | |
| C. | 等浓度等体积的NaHCO3溶液与NaCl溶液混合后:$\frac{1}{2}$ c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 标况下,将2.24LSO2气体通入到100ml 1mol•L-1的NaOH溶液中,完全反应后溶液呈酸性,则该溶液中: c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) |
20.常温下,下列是人体中几种体液的正常pH,碱性最强的是( )
| A. | 血浆(7.35~7.45) | B. | 胰液(7.5~8.0) | C. | 胃液(0.9~1.5) | D. | 唾液(6.6~7.1) |
17.CH2=CH-COOH能发生的反应是( )
①加成②酯化③氧化④银镜⑤置换⑥加聚.
①加成②酯化③氧化④银镜⑤置换⑥加聚.
| A. | 除④以外 | B. | 只有①③⑥ | C. | 只有①④⑤⑥ | D. | 全部 |
4.2008年9月国家有关部门检出了以三鹿婴幼儿奶粉为首的一批奶制品中掺和的三聚氰胺,并立即对全国的这些奶制品加以封存或销毁.三聚氰胺本是一种优良的化工原料,主要用来制涂料和黏合剂,它的相对分子质量介于100与200之间,碳的质量分数为28.57%,碳、氢的质量比为6:1,其余为氮.则三聚氰胺的分子式为( )
| A. | (CH2N2)n | B. | C3H4ON5 | C. | C3H6N6 | D. | C4H4N5 |
14.对于可逆反应2A(g)+B(g)?3C(g),在温度一定下由A(g)和B(g)开始反应,下列说法正确的是( )
| A. | A(g)的消耗速率与c(g)的生成速率比为2:3 | |
| B. | 由于该反应是等体积反应,所以增大压强正、逆反应速率不变 | |
| C. | 正、逆反应速率的比值是恒定的 | |
| D. | 当反应达到平衡状态时,充入一定量的A时,v正(A)增大的同时v逆(C)也增大 |
1.在恒温恒容条件下,能使A(g)+B(g)?C(g)+D(g)正反应速率增大的措施是( )
| A. | 增大C或D的浓度 | B. | 减小B或A的浓度 | C. | 减小C或D的浓度 | D. | 充入稀有气体 |
18.(CN)2、(SCN)2等的性质与卤素单质相似,在化学上称为“类卤素”;CN-、SCN-等的性质也与卤离子相似,称为“类卤离子”;不同卤原子能组成卤素互化物,如溴化碘IBr,下面叙述正确的是( )
| A. | (CN)2在碱溶液中生成CN-和OCN- | |
| B. | IBr+2NaOH═NaBr+NaIO+H2O | |
| C. | 均能在空气中燃烧 | |
| D. | IBr与苯发生取代反应生成溴苯和碘化氢 |
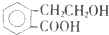 ,它可通过不同化学反应分别制得B、C、D、E四种物质.
,它可通过不同化学反应分别制得B、C、D、E四种物质.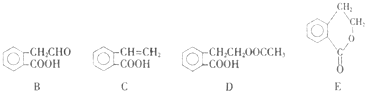
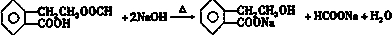 .
.