题目内容
【题目】从海水中提取镁的流程如图所示(框图中是主要产物):
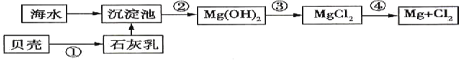
请回答相关问题。
(1)下列说法不正确的是____________。
A.上述方法的优点之一是原料取自大海 B.进行①②③步骤的目的是富集![]()
C.工业上也可用电解熔融氧化镁的方法制取镁 D.电解法冶炼金属要消耗大量的电能
(2)步骤③中发生反应的离子方程是__________________________。
(3)步骤④中发生反应的化学方程式是___________________________________。
【答案】C ![]()
![]() 。
。
【解析】
贝壳的主要成分是碳酸钙,高温分解生成氧化钙,氧化钙溶于水生成氢氧化钙,进入沉淀池与镁离子结合生成氢氧化镁沉淀,氢氧化镁溶于盐酸转化为氯化镁,电解熔融的氯化镁生成镁和氯气,据此解答。
(1)A.海水和贝壳均来自于大海,因此上述方法的优点之一是原料取自大海,A正确;
B.根据以上分析可知进行①②③步骤的目的是富集![]() ,B正确;
,B正确;
C.氧化镁的熔点太高,工业上不能利用电解熔融氧化镁的方法制取镁,C错误;
D.电解法冶炼金属要消耗大量的电能,D正确。
答案选C。
(2)步骤③是盐酸溶解氢氧化镁,其中发生反应的离子方程是![]() 。
。
(3)步骤④是电解熔融的氯化镁冶炼金属镁,其中发生反应的化学方程式是![]() 。
。

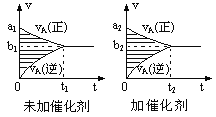
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
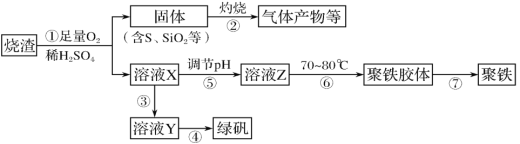
【题目】皮革工业污泥中含较多的Cr,工业采用以下工芝制得M[Cr(OH)(H20)5S04]。
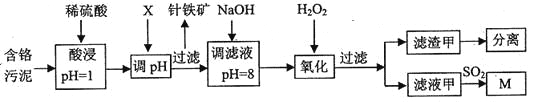
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 3.7 | 4.7 | 6.7 | --- |
沉淀完全时的pH | 3.2 | 8.0 | 6.7 | 9.3 | 9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是________(任写一条)。
(2)调节pH所用X可以选用______。
A.NaOH B.Na2C03C.H2S04D.HN03
(3)加入H202目的,是把Cr(OH)3沉淀转化为Cr2072-。该转化过程中,消耗的H202与Cr(OH)3的物质的量之比为________。
(4)调滤液至pH=8,则滤液中______将转化为沉淀(选填Al3+、Cu2+、Mg2+)。
(5)若滤液甲的pH=a,则溶液中c(Cu2+)=______。(25°C时的Ksp[Cu(OH)2]=2.2×10-20)