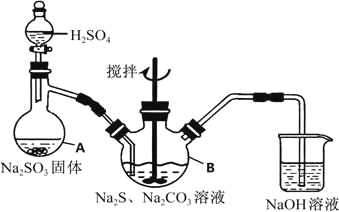
题目内容
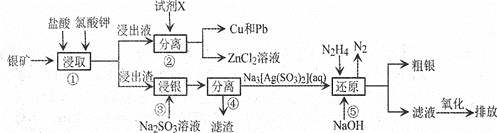
【题目】已知:氯酸钾能氧化Ag、Zn等金属。从一种银矿![]() 含Ag、Zn、Cu、Pb及少量
含Ag、Zn、Cu、Pb及少量![]() 中提取Ag、Cu及Pb的工艺流程如下:
中提取Ag、Cu及Pb的工艺流程如下:
![]() 步骤
步骤![]() 提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________
提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________![]() 写出两种即可
写出两种即可![]() 。
。
![]() 步骤
步骤![]() 试剂X为________
试剂X为________![]() 填化学式,下同
填化学式,下同![]() ;步骤
;步骤![]() 滤渣的成分为________。
滤渣的成分为________。
![]() 步骤
步骤![]() 发生反应的化学方程式为________。
发生反应的化学方程式为________。
![]() 步骤
步骤![]() 发生反应的离子方程式为________;其中
发生反应的离子方程式为________;其中![]() 肼
肼![]() 的电子式为________。
的电子式为________。
![]() 还原后的“滤液”经氧化后,其中的溶质为________。
还原后的“滤液”经氧化后,其中的溶质为________。
![]() 粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
【答案】适当增大液固比、适当提高浸取温度、适当延长浸取时间等 ![]()
![]()
![]()
![]()
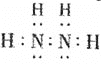
![]()
![]() ,
,![]()
【解析】
银精矿中的化学成分有: Ag、Zn、Cu、Pb、S及SiO2等,加盐酸和氯酸钾浸取,过滤,溶液中含有Zn2+、 Cu2+ 、Pb2+ 。滤渣中含有SiO2、 AgCl等;浸出液中加金属还原剂Zn,把Cu2+、Pb2+还原为单质,则试剂X为Zn,分离操作②为过滤,得到Cu和Pb、ZnCl2溶液;浸出渣含有SiO2、AgCl, 加Na2SO3溶液,AgCl与Na2SO3反应生成Na3[Ag ( SO3) 2]和NaCl,过滤,滤渣为SiO2,滤液为Na3[Ag ( SO3) 2]和NaCl,在滤液中加N2H4,生成Ag和氮气;滤液中含有亚硫酸钠,氧化生成硫酸钠,以此解答该题。
银矿![]() 含Ag、Zn、Cu、Pb及少量
含Ag、Zn、Cu、Pb及少量![]() ,加盐酸和氯酸钾浸取,过滤,溶液中含有
,加盐酸和氯酸钾浸取,过滤,溶液中含有![]() 、
、![]() 、
、![]() ,滤渣中含AgCl、
,滤渣中含AgCl、![]() ,浸出液中加金属还原剂,把
,浸出液中加金属还原剂,把![]() 、
、![]() 还原为单质,则试剂X为Zn,分离操作
还原为单质,则试剂X为Zn,分离操作![]() 为过滤,得到Cu、Pb、氯化锌溶液,浸出渣含有AgCl、
为过滤,得到Cu、Pb、氯化锌溶液,浸出渣含有AgCl、![]() ,加亚硫酸钠溶液,氯化银与亚硫酸钠反应生成
,加亚硫酸钠溶液,氯化银与亚硫酸钠反应生成![]() 和氯化钠,过滤,滤渣为二氧化硅,滤液为
和氯化钠,过滤,滤渣为二氧化硅,滤液为![]() 和氯化钠,在滤液中加入
和氯化钠,在滤液中加入![]() 和氢氧化钠,生成银和氮气,滤液中含有亚硫酸钠,氧化亚硫酸钠后排放。
和氢氧化钠,生成银和氮气,滤液中含有亚硫酸钠,氧化亚硫酸钠后排放。
![]() 步骤
步骤![]() 提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是适当增大液固比、适当提高浸取温度、适当延长浸取时间等,故答案为:适当增大液固比、适当提高浸取温度、适当延长浸取时间等;
提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是适当增大液固比、适当提高浸取温度、适当延长浸取时间等,故答案为:适当增大液固比、适当提高浸取温度、适当延长浸取时间等;
![]() 步骤
步骤![]() 试剂X为Zn;步骤
试剂X为Zn;步骤![]() 滤渣的成分为
滤渣的成分为![]() ,故答案为:Zn;
,故答案为:Zn;![]() ;
;
![]() 步骤
步骤![]() 为氯化银与亚硫酸钠反应生成
为氯化银与亚硫酸钠反应生成![]() 和氯化钠,发生反应的化学方程式为
和氯化钠,发生反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 步骤
步骤![]() 为
为![]() 、
、![]() 和氢氧化钠反应,生成银和氮气,发生反应的离子方程式为
和氢氧化钠反应,生成银和氮气,发生反应的离子方程式为![]() ;
;![]() 肼
肼![]() 的电子式为
的电子式为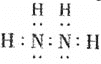 ,故答案为:
,故答案为:![]() ;
;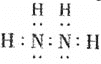 ;
;
![]() 亚硫酸钠经氧化后生成硫酸钠,其中的溶质为
亚硫酸钠经氧化后生成硫酸钠,其中的溶质为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 在阴极上有无色气体产生,在液面上方变为红棕色,则无色气体为NO,NO与氧气反应生成红棕色的
在阴极上有无色气体产生,在液面上方变为红棕色,则无色气体为NO,NO与氧气反应生成红棕色的![]() 。电解时阴极发生还原反应,
。电解时阴极发生还原反应,![]() ,
,![]() ,故答案为:
,故答案为:![]() ,
,![]() 。
。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】一定温度下,向 2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前 50 s 的平均速率v(PCl3)=0.0032 mol·L1·s1
B.该条件下,反应的平衡常数K=0.05
C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L1,则反应的ΔH<0
D.其他条件相同时,向空的容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,此时 v(正)>v(逆)