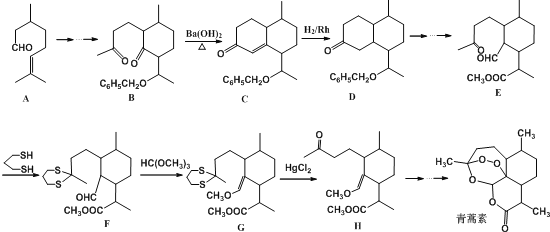
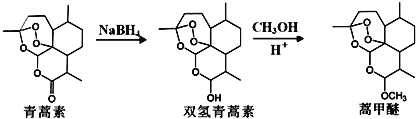
题目内容
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为________。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
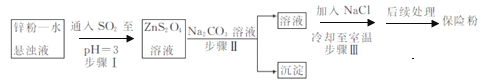
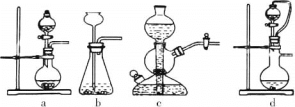
①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_______。步骤Ⅱ中发生反应的化学方程式为___。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是_______。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是___________。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02molL-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______gL-1。(以SO2计)
【答案】2Na2S2O4+O2=2Na2SO3+2SO2 ad 增大锌粉的表面积,加快反应速率 ZnS2O4+Na2CO3=Na2S2O4+ZnCO3↓ 除去晶体表面的水分,并减少Na2S2O4的溶解损失 HCOONa+NaOH+2SO2=Na2S2O4+CO2+H2O 0.256
【解析】
(1)根据已知的反应物、生成物,结合电子守恒,书写反应方程式;
(2)①结合物质的存在状态及反应条件,判断使用的装置;
②根据化学反应速率影响因素分析,结合复分解反应规律书写反应方程式;
③结合物质的溶解性分析;
(3)根据题干信息,书写反应方程式;
(4)根据氧化还原反应中电子转移数目相等计算。
(1) Na2S2O4与O2生成Na2SO3和SO2,反应方程式为2Na2S2O4+O2=2Na2SO3+2SO2;
(2)①浓硫酸与Na2SO3发生复分解反应产生Na2SO4、SO2、H2O,反应方程式为:H2SO4+Na2SO3=Na2SO4+SO2↑+H2O,
a.反应不需要加热,Na2SO3是细小晶体,通过控制分液漏斗的活塞控制反应速率,装置a合理;
b.不能控制反应速率,且浓硫酸具有吸水性,长颈漏斗容易导致浓硫酸稀释,b不合理;
c.浓硫酸与盐的反应放出大量的热,会导致集气瓶炸裂,c不合理;
d.通过控制分液漏斗的活塞控制反应速率,上下联通的导气管会使浓硫酸上下气体压强一致,便于浓硫酸顺利滴下,装置d合理;
故合理选项是ad;
②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是增大锌粉的表面积,加快反应速率。根据流程图可知步骤Ⅱ中发生复分解反应的化学方程式为ZnS2O4+Na2CO3=Na2S2O4+ZnCO3↓;
③Na2S2O4易溶于水,难溶于乙醇,用乙醇洗涤,既能除去晶体表面的水分,并减少Na2S2O4的溶解损失;
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙 醇水溶液液中,然后通入SO2发生反应,产生Na2S2O4,同时有CO2气体放出和水生成,总反应的化学方程式是HCOONa+NaOH+2SO2=Na2S2O4+CO2+H2O。
(4)根据氧化还原反应中电子转移数目相等可知两种物质的反应关系为:2K3[Fe(CN)6] ~~Na2S2O4,n{K3[Fe(CN)6]}=0.02mol/L×0.01L=2×10-4mol,则n(Na2S2O4)=1×10-4mol,溶液的体积是50mL=0.05L,所以c(Na2S2O4)= 1×10-4mol÷0.05L=2×10-3mol/L,根据S元素守恒,该样品中Na2S2O4的含量以SO2计为:2×10-3mol/L ×2×64g/mol=0.256gL-1。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。学习物质结构与性质,回答下列问题:
(1)太阳中的主要化学元素是氢和_______。
(2)氢负离子H-基态电子排布式为_______。
(3)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子H-的第一电离能为________。
(4)几种碱金属氢化物的部分性质如下表所示:
氢化物 | LiH | NaH | KH |
密度/g/cm3 | 0.78 | 1.43 | |
分解温度/℃ | 850 | 425 | 400 |
从化学结构的角度回答说明,分解温度LiH>NaH>KH___。
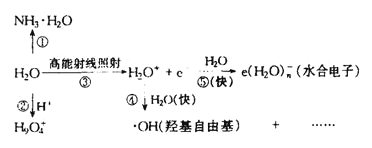
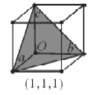
(5)水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中,中心原子的杂化类型是___,请画出H5O2+的结构式:______。当用高能射线照射液态水时,水分子便以一种新的方式电离,如图所示写出高能射线照射水的总反应的离子方程式_______。
(6)氢化铝钠(NaAlH4)等复合氢化物是重要的有机还原剂。NaAlH4晶胞结构如图所示,NaAlH4晶体中,与Na+紧邻且等距的A1H4-有___个,设阿伏伽德罗常数为NA,则晶体的密度为___g·cm-3。
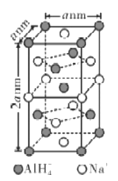
(7)在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如图则该立方晶胞体中(1,1,1)晶面共有___个。
【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
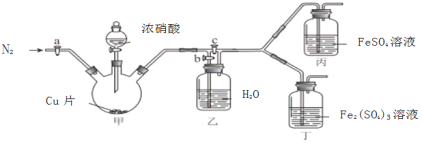
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。