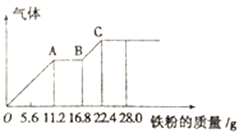
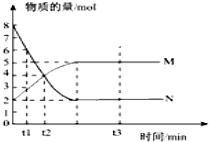
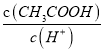题目内容
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若有2molN2生成,则下列判断正确的是
A. 生成44.8LN2
B. 有0.125molKNO3被氧化
C. N2既是氧化产物又是还原产物
D. 转移电子的物质的量为10mol
【答案】C
【解析】该反应中N元素化合价由-![]() 价、+5价变为0价,所以氧化产物和还原产物都是氮气,假设有16mol氮气生成,氧化产物是15mol、还原产物是1mol,若有2molN2生成,则参加反应的n(KNO3)=
价、+5价变为0价,所以氧化产物和还原产物都是氮气,假设有16mol氮气生成,氧化产物是15mol、还原产物是1mol,若有2molN2生成,则参加反应的n(KNO3)=![]() =0.25mol, A.标准状况下生成氮气的体积为44.8 L,但题干中没有说明,选项A错误;B.硝酸钾得电子作氧化剂而被还原,选项B错误;C.根据上述分析,N2既是氧化产物又是还原产物,选项C正确;D、转移电子的物质的量=3n(KNO3)=5×0.25mol=1.25mol,选项D错误;答案选C。
=0.25mol, A.标准状况下生成氮气的体积为44.8 L,但题干中没有说明,选项A错误;B.硝酸钾得电子作氧化剂而被还原,选项B错误;C.根据上述分析,N2既是氧化产物又是还原产物,选项C正确;D、转移电子的物质的量=3n(KNO3)=5×0.25mol=1.25mol,选项D错误;答案选C。

【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
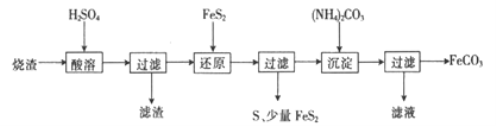
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________