题目内容
【题目】设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
A.常温常压下,22.4 L乙烯中含C﹣H键的数目为4NA
B.1molFe与足量盐酸反应转移电子数为3NA
C.1.6g由氧气和臭氧组成的混合物中含有的氧原子数目为0.1NA
D.向1L 1 molL﹣1氯化铝溶液中加入足量的氨水,生成AlO2﹣的个数为NA
【答案】C
【解析】解:A.不是标况下,不能使用标况下的气体摩尔体积计算22.4L乙烯的物质的量,故A错误; B.1mol铁与足量盐酸反应生成1mol氯化亚铁,失去了2mol电子,反应转移电子数为2NA , 故B错误;
C.1.6g由氧气和臭氧组成的混合物中含有1.6g氧原子,含有氧原子的物质的量为: ![]() =0.1mol,含有的氧原子数目为0.1NA , 故C正确;
=0.1mol,含有的氧原子数目为0.1NA , 故C正确;
D.氨水为弱碱,氯化铝与氨水反应生成产物为氢氧化铝沉淀,不会生成偏铝酸根离子,故D错误;
故选C.

【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
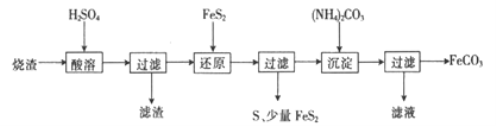
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________