题目内容
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是
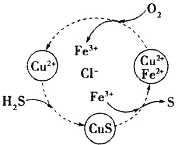
A.在转化过程中化合价不变的元素只有Cu和Cl
B.由图示的转化可得出氧化性的强弱顺序:O2>Cu2+>S
C.在转化过程中能循环利用的物质只有FeCl2
D.反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为16g
【答案】D
【解析】
A.根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,故A错误;
B.转化过程中O2把Fe2+氧化为Fe3+,Fe3+把硫离子氧化为S,则氧化性的强弱顺序:O2>Fe3+>S,故B错误;
C.根据图示,反应的本质是空气中的氧气氧化H2S转化为S和水,在转化过程中能循环利用的物质有FeCl2、CuCl2、FeCl3,故C错误;
D.H2S转化为硫单质,硫元素的化合价从-2价变成0价,氧元素的化合价从0价变成-2价,依据得失电子数相等,所以2H2S----O2,所以有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为![]() ×
×![]() ×32g/mol=16g,故D正确;
×32g/mol=16g,故D正确;
故选D。

 优加精卷系列答案
优加精卷系列答案【题目】某小组研究铁与水蒸气的反应,两位同学分别进行了如下实验。
实验Ⅰ | 实验Ⅱ |
|
|
请回答:
(1)实验Ⅰ中湿棉花的作用是______________。
(2)实验Ⅰ中反应的化学方程式是__________。
(3)甲同学观察到实验Ⅰ中持续产生肥皂泡,实验Ⅱ中溶液B呈现红色。说明溶液A中含有___________。
(4)乙同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色。溶液B未呈现红色的原因是____________。
【题目】下列方案设计能达到实验目的的是
A | B | C | D |
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D
【题目】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:

小组记最的实验现象如下表所示:
开始时 | 5min 后 | 3天后 | |
实验I | 溶液立即变为红褐色,比II、III中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验II | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验III | 溶液立即变为红褐色 | 红褐色变浅,比II中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/LFeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是_______________(用离子方程式表示)。
(2)开始混合时,实验I中红褐色比II、III中略浅的原因是____________________________。
(3)为了探究5min后实验II、III中溶液红褐色变浅的原因,小组同学设计了实验IV;分别取少量 5min后实验I、II、III中溶液,加入2滴铁氰化钾溶液,发现实验II、III中出现蓝色沉淀,实验I中无明显变化。试用方程式解释溶液中出现Fe2+的原因______________________________。
(4)针对5min后实验III中溶液颜色比实验II中深,小组同学认为可能存在三种因素:
①Cl-可以加快Fe3+与SO32-的氧化还原反应:
②NO3-可以______________________________;
③NO3-在酸性环境下代替Fe3+氧化了SO32-,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验V和实验VI进行因素探究:
实验操作(己知Na+对实验无影响) | 5min后的现象 | |
实验V | 在2mLpH=1.0的0.4mol/L Fe(NO3)3溶液中溶解 固体,再加入2滴0.4mol/L Na2SO3溶液 | 溶液的红褐色介于II、III之间 |
实验VI | 在2mLpH=1.0的稀硝酸中溶解约0.19gNaNO3固体,再加 入2滴0.4mol/LNa2SO3溶液。向其中滴入少量BaCl2溶液 | _______________________。 |
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述时间,以下结果或推论合理的是_______________(填字母)。
a.Fe3+与SO32-同时发生水解反应和氧化还原反应,且水解反应的速率快,等待足够长时间后,将以氧化还原反应为主
b.浓度为1.2mol/L的稀硝酸在5min内不能将Fe2+氧化
c.向pH大于1的稀硝酸中加入少量Ba(NO3)2,使其完全溶解,可用来检验实验1的上层淸液中是否存在SO42-