题目内容
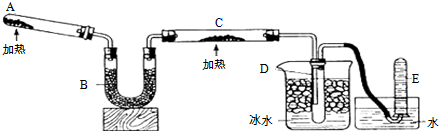
3.利用如图所示装置和其他必要的仪器用品,完成下列实验.
证明氨气具有还原性.已知:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O.
(1)碱石灰的作用是干燥氨气,稀硫酸的作用是吸收过量的氨气.
(2)烧瓶中固体NaOH可以用AC代替.(填写代号)
A.碱石灰 B.氯化钠 C.生石灰
(3)证明NH3具有还原性的实验现象是硬质试管中黑色固体变红色.
分析 浓氨水逐滴加入到氢氧化钠固体或者生石灰、碱石灰可以制取氨气,氨气为碱性气体应选择碱性干燥剂碱石灰干燥,氨气具有还原性,与氧化铜发生还原反应生成氮气和铜、水,为防止过量氨气污染空气,可用稀硫酸吸收氨气,据此解答.
解答 解:(1)制取的氨气中含有水蒸气,铵气与氧化铜反应需要加热,所以氨气进入硬质试管前应进行干燥,所以碱石灰作用为干燥氨气;
过量的氨气能够污染空气,应进行尾气处理,氨气能够与稀硫酸反应,可用稀硫酸吸收过量的氨气;
故答案为:干燥氨气;吸收过量的氨气;
(2)浓氨水易挥发,NaOH与水溶解或CaO固体与水反应放出大量的热,导致温度升高,使得氨气在水中的溶解度进一步减少,以气体的形式溢出,制得氨气;
故选:AC;
(3)氨气具有还原性,与氧化铜发生还原反应生成氮气和铜、水,现象是硬质试管中黑色固体变红色,故答案为:硬质试管中黑色固体变红色.
点评 本题考查了氨气的制备和性质的检验,熟悉实验原理及氨气的性质是解题关键,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
14.下列离子方程式正确的是( )
| A. | Fe粉加入稀盐酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 金属钠投到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 石灰石投入到稀盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钠溶液加入到稀硫酸中:OH-+H+═H2O |
12.证明溶液中是否含有Fe2+,其操作可以是①加入少量KMnO4溶液;②滴入少许KSCN溶液;③加入少许氯水.其中正确的是( )
| A. | 先①后② | B. | 先②后① | C. | 先②后③ | D. | 先③后② |
12.在下列概念中,前者不包括后者的是( )
| A. | 氧化物、酸性氧化物 | B. | 化合物、电解质 | ||
| C. | 氧化还原反应、复分解反应 | D. | 氧化还原反应、置换反应 |
13.丙烯醇在一定条件下可转化为丙烯醛:CH2=CHCH2OH$→_{25℃}^{新型MnO_{2}}$CH2=CHCHO+H2,下列有关说法错误的是( )
| A. | 丙烯醇与丙醛(CH3CH2CHO)互为同分异构体 | |
| B. | 丙烯醇、丙烯醛均含有两种官能团 | |
| C. | 1 mol丙烯醛可以和2 mol氢气发生加成反应 | |
| D. | 此转化过程中丙烯醇被还原 |
 .
. .
.