题目内容
15.A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,A、B、F三者原子序数之和为25,且知B、F同主族,1.8gE与足量的盐酸反应生成ECl3和2.24L氢气(标准状况下),D+和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,试判断:(1)六种元素中非金属性最强的是C(填代号),该元素位于周期表中第二周期第ⅤⅡA族;由A、B、D三种元素形成化合物的电子式
 .
.(2)下列能够说明B、F非金属性强弱的方法有bd
a.最高价氧化物对应水化物酸性 b.气态氢化物的热稳定性
c.气态氢化物的沸点B比F高 d.向F的气态氢化物溶液中通入B单质,有浑浊.
(3)写出下列反应的化学方程式
①E与足量的盐酸反应的化学方程式2Al+6HCl=2AlCl3+3H2↑
②工业上用电解法冶炼E单质2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
(4)写出足量D的高价氧化物对应水化物与ECl3相互反应的离子方程式4OH-+Al3+=AlO2-+2H2O.
分析 A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,1.8gE与足量盐酸反应生成ECl3和2.24L氢气(标况),故E为+3价元素,设E的相对原子质量为M,则$\frac{2.24L}{22.4L/mol}$,解M=27,故E为ⅢA族元素,依据计算得知E为铝,工业上用电解氧化铝方法冶炼铝单质,所以B为氧元素,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,且D+离子和Al离子具有相同的电子结构,故D能形成+1价阳离子,故D为钠,C的原子序数大于氧小于钠,且为主族元素,故C为氟,据此答题.
解答 解:A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,1.8gE与足量盐酸反应生成ECl3和2.24L氢气(标况),故E为+3价元素,设E的相对原子质量为M,则$\frac{2.24L}{22.4L/mol}$,解M=27,故E为ⅢA族元素,依据计算得知E为铝,工业上用电解氧化铝方法冶炼铝单质,所以B为氧元素,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,且D+离子和Al离子具有相同的电子结构,故D能形成+1价阳离子,故D为钠,C的原子序数大于氧小于钠,且为主族元素,故C为氟,
(1)根据元素周期律,同周期元素从前向后,非金属性逐渐增强,同主族元素从上向下,非金属性逐渐减弱,所以六种元素中非金属性最强的是C,C为氟,位于周期表中第二 周期第ⅤⅡA 族,由A、B、D三种元素形成化合物为氢氧化钠,它的电子式是 ,
,
故答案为:C;二;ⅤⅡA; ;
;
(2)a.氧元素没有最高价氧化物对应水化物,故a错误;
b.根据元素周期律,气态氢化物的热稳定性越稳定,元素的非金属性越强,故b正确;
c.气态氢化物的沸点与分子间作用力有关,与元素的非金属性无关,故c错误;
d.向硫的气态氢化物溶液中通入氧气,有浑浊,说明氧气的氧化性强于硫,即氧的非金属性强于硫,故d正确,
故选bd;
(3)①Al与足量的盐酸反应的化学方程式为2Al+6HCl=2AlCl3+3 H2↑,故答案为:2Al+6HCl=2AlCl3+3 H2↑;
②工业上用电解法冶炼Al单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
(4)氢氧化钠与AlCl3相互反应的离子方程式为4OH-+Al3+=AlO2-+2H2O,故答案为:4OH-+Al3+=AlO2-+2H2O.
点评 本题考查原子结构与元素周期律,元素的推断是解答本题的关键,熟悉化学用语的使用即可解答,题目难度中等.

| A. | $\frac{4}{5}$v (NH3)=v (O2) | B. | $\frac{5}{6}$v (O2)=v (H2O) | C. | $\frac{3}{2}$v (NH3)=v (H2O) | D. | $\frac{5}{4}$v (O2)=v (NO) |
| A. | 丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 过滤和蒸发操作均用到玻璃棒,但玻璃棒的作用不相同 | |
| C. | 加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- | |
| D. | 氨气能使湿润的红色石蕊试纸变蓝,说明氨气的水溶液呈碱性 |
| A. | O2与O3 | B. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U | ||
| C. | ${\;}_1^2$H2与H2 | D. | ${\;}_1^2$H2O与H2O |
| A. | Na2SO3中硫元素化合价升高 | B. | 该反应是复分解反应 | ||
| C. | H2SO4发生氧化反应 | D. | NaClO3是还原剂 |
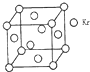 测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=3(填数字).
测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=3(填数字).