题目内容
14.下列离子方程式正确的是( )| A. | Fe粉加入稀盐酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 金属钠投到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 石灰石投入到稀盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钠溶液加入到稀硫酸中:OH-+H+═H2O |
分析 A.不符合反应客观事实;
B.原子个数守恒;
C.碳酸钙为沉淀,应保留化学式;
D.反应生成氯化钠和水.
解答 解:A.铁与盐酸反应生成二价铁离子,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.金属钠投到水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.石灰石投入到稀盐酸中,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故C错误;
D.氢氧化钠溶液加入到稀硫酸中,离子方程式:OH-+H+═H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分和电荷守恒,题目难度不大.

练习册系列答案
相关题目
4.取pH均等于2的盐酸和醋酸各100L,分别稀释2倍后,再分别加入足量的锌粉,在相同条件下充分反应,有关叙述正确的是( )
| A. | 醋酸与锌粉反应放出的氢气少 | |
| B. | 盐酸和醋酸与锌反应放出氢气一样多 | |
| C. | 醋酸与锌反应速率大 | |
| D. | 盐酸、醋酸与锌反应的速率一样大 |
2.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2O含有的分子数为NA | |
| B. | 一定条件下,56克铁粉与足量的HCl溶液完全反应,转移电子数为3NA | |
| C. | 标准状况下,22.4L氦气中所含原子数为NA | |
| D. | 1 mol•L-1 NaCl溶液中所含有的Na+离子数目为NA |
9.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ | |
| C. | 在温度、体积不变的情况下,若按照起始充入比例再向容器中充入反应物,重新达平衡后,HCl的体积分数不变 | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应 |
19.标准状况下,与16gO2所占体积大致相等的是( )
| A. | 0.5molH2O | B. | 5.6L甲烷 | C. | 3.01×1023个N2 | D. | 44gCO2 |
6.已知:4NH3+5O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$4NO+6H2O,若反应速率用v表示,以下关系正确的是( )
| A. | $\frac{4}{5}$v (NH3)=v (O2) | B. | $\frac{5}{6}$v (O2)=v (H2O) | C. | $\frac{3}{2}$v (NH3)=v (H2O) | D. | $\frac{5}{4}$v (O2)=v (NO) |
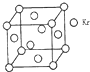 测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=3(填数字).
测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=3(填数字).