题目内容
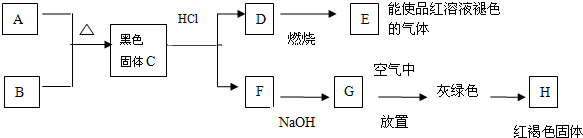
12.证明溶液中是否含有Fe2+,其操作可以是①加入少量KMnO4溶液;②滴入少许KSCN溶液;③加入少许氯水.其中正确的是( )| A. | 先①后② | B. | 先②后① | C. | 先②后③ | D. | 先③后② |
分析 先根据Fe3+的特征反应判断溶液不含Fe3+;然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在.
解答 解:因为KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,可以先滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,
再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液含有Fe2+,即先②后③,
故选C.
点评 本题考查离子的检验,注意滴加氧化剂、KSCN溶液的顺序不能颠倒,如果颠倒,无法确定溶原液将中是否含有Fe3+.

练习册系列答案
相关题目
2.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2O含有的分子数为NA | |
| B. | 一定条件下,56克铁粉与足量的HCl溶液完全反应,转移电子数为3NA | |
| C. | 标准状况下,22.4L氦气中所含原子数为NA | |
| D. | 1 mol•L-1 NaCl溶液中所含有的Na+离子数目为NA |
20.以下各组微粒互为同位素的是( )
| A. | O2与O3 | B. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U | ||
| C. | ${\;}_1^2$H2与H2 | D. | ${\;}_1^2$H2O与H2O |
20.下列反应的离子方程式书写正确的是( )
| A. | 向饱和碳酸氢钙溶液中加入过量氢氧化钙溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | 用氢氧化钠溶液吸收二氧化碳:2OH-+CO2=CO32-+H2O | |
| D. | Mg(HCO3)2 溶液 与过量 NaOH 溶液反应:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
1.下列关于反应过程中能量变化的表达正确的是( )
| A. | 丁烷的燃烧热是2878 kJ/mol,则表示丁烷燃烧热的热化学方程式为:C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2878 kJ/mol | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2.则△H1>△H2 | |
| C. | 已知①2H2(g)+O2(g)═2H2O(g)△H1=a kJ•mol-1,②2H2(g)+O2(g)═2H2O(l)△H2=b kJ•mol-1,则a<b | |
| D. | 在一定条件下,某可逆反应的△H=+100 kJ•mol-1,则该反应正反应活化能比逆反应活化能大100 kJ•mol-1 |
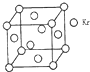 测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=3(填数字).
测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=3(填数字).