题目内容
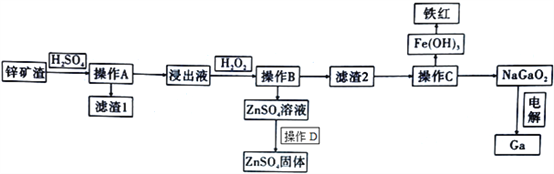
【题目】镓是制作高性能半导体的重要原料。在工业上经常从锌矿冶炼的废渣中回收镓。已知锌矿渣中含有Zn、Fe、Pb、Ga以及二氧化硅等,目前综合利用锌矿渣的流程如下:
已知:①Ga性质与铝相似。
②lg2=0.3,lg3=0.48。
③如下表所示。
Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 | |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)写出Ga的原子结构示意图______________________________。
(2)滤渣1的成分为________________________。
(3)加入H2O2的目的( 用离子方程式和适当语言回答) ____________________________________。
(4)室温条件下,若浸出液中各种阳离子的浓度均为0.01mo/L且某种离子浓度小于1×10-5 mol/L即认为该离子已完全除去,问操作B调节pH的范围是________________________。
(5)操作C中,需要加入氢氧化钠溶液,其目的是_____________________ (用离子方程式解释);能否用氨水代替NaOH溶液,为什么? ________________________;如何检测Fe(OH)3洗涤干净? ________________________。
(6)在工业上,经常用电解NaGaO2溶液的方法生产Ga,写出阴极的电极反应方程式:____________________________________。
【答案】  SiO2 PbSO4 2Fe2++H2O2+2H+=2Fe3++2H2O,防止生成Fe(OH)2 5.48≤pH<.6.6 Ga(OH)3+OH-=CaO2-+2H2O 不能,因为NH3·H2O 为弱碱,与Ga(OH)3不反应 取最后一次洗涤的滤液,用pH试纸测试pH值,若为中性则洗涤干净 GaO2 -+2H2O+3e-=Ga+4OH-
SiO2 PbSO4 2Fe2++H2O2+2H+=2Fe3++2H2O,防止生成Fe(OH)2 5.48≤pH<.6.6 Ga(OH)3+OH-=CaO2-+2H2O 不能,因为NH3·H2O 为弱碱,与Ga(OH)3不反应 取最后一次洗涤的滤液,用pH试纸测试pH值,若为中性则洗涤干净 GaO2 -+2H2O+3e-=Ga+4OH-
【解析】试题分析:本题以锌矿渣的综合利用流程为载体,考查流程的分析、原子结构示意图和离子方程式的书写、溶度积的计算和溶液pH的控制、电解原理。Ga的性质与Al相似,锌矿渣中加入H2SO4,充分反应,其中Zn、Fe、Ga转化为可溶于水的ZnSO4、FeSO4、Ga2(SO4)3,Pb转化成难溶于水的PbSO4,SiO2与H2SO4不反应,经过滤得到的滤渣1中成分为PbSO4、SiO2;向浸出液中加入H2O2,H2O2将Fe2+氧化成Fe3+,然后调节溶液的pH使Fe3+、Ga3+转化为氢氧化物沉淀与Zn2+分离;滤渣2的成分为Fe(OH)3和Ga(OH)3,根据图示应向滤渣2中加入NaOH使Ga(OH)3溶解转化为NaGaO2。
(1)Ga位于元素周期表中第四周期IIIA族,原子序数为31,Ga的原子结构示意图为 。
。
(2)根据上述分析,滤渣1的成分为SiO2、PbSO4。
(3)Fe2+具有还原性,H2O2将Fe2+氧化成Fe3+,加入H2O2的目的是:2Fe2++H2O2+2H+=2Fe3++2H2O2,防止生成Fe(OH)2沉淀。
(4)操作B调节pH的目的是:将Fe3+、Ga3+完全转化为氢氧化物沉淀,Zn2+不形成Zn(OH)2沉淀。Ga(OH)3、Fe(OH)3属于同种类型且Ksp[Ga(OH)3] ![]() Ksp[Fe(OH)3],Ga3+完全沉淀时Fe3+已经完全沉淀,Ga3+完全沉淀时c(Ga3+)
Ksp[Fe(OH)3],Ga3+完全沉淀时Fe3+已经完全沉淀,Ga3+完全沉淀时c(Ga3+)![]() 1
1![]() 10-5mol/L,c(OH-)=
10-5mol/L,c(OH-)=![]() =
=![]() =3
=3![]() 10-9mol/L,c(H+)=
10-9mol/L,c(H+)=![]() 10-5mol/L,pH=-lgc(H+)=-lg
10-5mol/L,pH=-lgc(H+)=-lg![]() 10-5=5.48;Zn2+开始沉淀时,c(OH-)=
10-5=5.48;Zn2+开始沉淀时,c(OH-)=![]() =
=![]() =4
=4![]() 10-8mol/L,c(H+)=
10-8mol/L,c(H+)=![]() 10-6mol/L,pH=-lgc(H+)=-lg
10-6mol/L,pH=-lgc(H+)=-lg![]() 10-6=6.6;操作B调节的pH范围是:5.48
10-6=6.6;操作B调节的pH范围是:5.48![]() pH
pH![]() 6.6。
6.6。
(5)根据流程,操作C中加入NaOH溶液的目的是:将Ga(OH)3溶解转化为NaGaO2,联想Al(OH)3与NaOH的反应,反应的离子方程式为Ga(OH)3+OH-=GaO2-+2H2O。不能用氨水代替NaOH溶液,原因是:NH3·H2O为弱碱,氨水与Ga(OH)3不反应。根据流程,Fe(OH)3沉淀上吸附的离子有Na+、OH-、GaO2- 等,检验Fe(OH)3洗涤干净只要检验最后的洗涤液中不含OH- 即可,检验Fe(OH)3洗涤干净的操作是:取最后一次洗涤的滤液,用pH试纸测试pH值,若为中性则洗涤干净。
(6)电解NaGaO2溶液生产Ga,Ga元素的化合价由+3价降为0价,GaO2- 转化为Ga为还原反应,电解时还原反应在阴极发生,阴极的电极反应式为:GaO2-+3e-+2H2O=Ga+4OH-。

【题目】三氯氧磷(POCl3)可用作有机合成的氯化剂和催化剂。
已知:①KSCN+AgNO3=AgSCN↓+KNO3;
②Ksp(AgCl) > Ksp(AgSCN);
③磷酸银可溶于硝酸;
④PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 性质 |
PCl3 | -111.8 | 74.2 | 137.5 | 均为无色液体,遇水均剧烈水解,生成含氧酸和氯化氢,两者互溶。 |
POCl3 | 2.0 | 105.3 | 153.5 |
实验室制取POCl3并测定产品纯度的实验过程如下:
Ⅰ.制备POCl3可用氧气氧化液态PCl3的方法。实验装置(加热及夹持装置省略)如下:

(1)装置C中盛装PCl3的仪器名称为_______________________;氧气氧化PCl3的化学方程式为_______________________________。
(2)仪器组装完成后,检查装置B气密性的方法是_______________________________。
(3)装置B的作用有________________________________(回答两点)。
(4)装置C的反应温度控制在60-65℃之间,原因是____________________________________。
Ⅱ.测定产品中POCl3纯度的实验步骤:
①实验Ⅰ结束后,待反应器中液体冷却到室温,准确称取1.3300 g的POCl3粗产品(杂质不含氯元素),置于盛有50.00mL蒸馏水的烧杯中摇动至完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入30.00mL0.1200mol·L-1AgNO3标准溶液;
③加入少量硝基苯,用力摇动,静置;
④加入指示剂,用0.1000 mol·L-1KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去12.00mLKSCN溶液。
(5)滴定过程中选择的指示剂为___________溶液。
(6)步骤③的目的是___________________________________________________。
(7)测得产品中POCl3的纯度为__________%。