题目内容
【题目】某温度下,在76 g水中溶解24 g CuSO4,恰好达到饱和,假设该溶液密度为1 g·cm-3,求:
(1)该溶液中溶质的质量分数_______;
(2)该溶液中溶质的物质的量浓度_______;
(3)取10mL该溶液加水稀释至200mL,稀释后的溶液物质的量浓度为多少_______?
【答案】24% 1.5mol·L-1 0.075mol·L-1
【解析】
(1)根据w=![]() ×100%计算出该溶液中溶质的质量分数;(2)根据c=
×100%计算出该溶液中溶质的质量分数;(2)根据c=![]() 计算出该溶液的物质的量浓度;(3)根据稀释过程中溶质的物质的量不变计算出稀释后溶液的浓度;据此分析解答。
计算出该溶液的物质的量浓度;(3)根据稀释过程中溶质的物质的量不变计算出稀释后溶液的浓度;据此分析解答。
(1)在76g水中溶解24gCuSO4,该溶液中溶质的质量分数为:![]() ×100%=24%,故答案为:24%;
×100%=24%,故答案为:24%;
(2)根据(1)可知,该溶液的质量分数为24%、密度为1gcm-3,则该溶液的物质的量浓度为:c=![]() =
=![]() mol/L=1.5mol/L,故答案为:1.5 mol/L;
mol/L=1.5mol/L,故答案为:1.5 mol/L;
(3)取10mL该溶液加水稀释至200mL,稀释过程中溶质的物质的量不变,则稀释后的溶液物质的量浓度为:![]() =0.075mol/L,故答案为:0.075 mol/L。
=0.075mol/L,故答案为:0.075 mol/L。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】镓是制作高性能半导体的重要原料。在工业上经常从锌矿冶炼的废渣中回收镓。已知锌矿渣中含有Zn、Fe、Pb、Ga以及二氧化硅等,目前综合利用锌矿渣的流程如下:
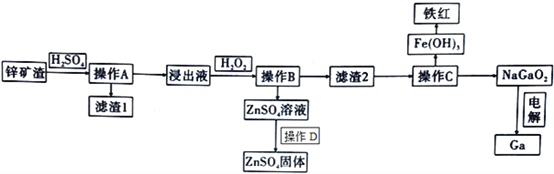
已知:①Ga性质与铝相似。
②lg2=0.3,lg3=0.48。
③如下表所示。
Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 | |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)写出Ga的原子结构示意图______________________________。
(2)滤渣1的成分为________________________。
(3)加入H2O2的目的( 用离子方程式和适当语言回答) ____________________________________。
(4)室温条件下,若浸出液中各种阳离子的浓度均为0.01mo/L且某种离子浓度小于1×10-5 mol/L即认为该离子已完全除去,问操作B调节pH的范围是________________________。
(5)操作C中,需要加入氢氧化钠溶液,其目的是_____________________ (用离子方程式解释);能否用氨水代替NaOH溶液,为什么? ________________________;如何检测Fe(OH)3洗涤干净? ________________________。
(6)在工业上,经常用电解NaGaO2溶液的方法生产Ga,写出阴极的电极反应方程式:____________________________________。