题目内容
【题目】下列各组离子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式正确的是
选项 | 离子组 | 试剂X | 发生反应的离子方程式 |
A | K+、Na+、 | 少量HCl | H2O+H++ |
B |
| 少量H2S | Fe2++H2S=FeS↓+2H+ |
C | ClO-、Na+、Ca2+、 | 少量CO2 | CO2+Ca2++H2O+2ClO-=CaCO3↓+2HClO |
D | I-、Cl-、Na+、 | 少量稀硝酸 | 6I-+2 |
A.AB.BC.CD.D
【答案】C
【解析】
A.原溶液中碳酸氢根与偏铝酸根不能共存可以发生反应生成氢氧化铝沉淀,离子方程式为![]() +
+![]() +H2O= Al(OH)3↓+
+H2O= Al(OH)3↓+![]() ,A错误;
,A错误;
B.选项中四种离子可以共存,通入硫化氢气体后,无明显现象,B错误;
C.选项中四种离子可以共存,向含有四种离子的溶液中通入少量的二氧化碳,二氧化碳溶于水生成碳酸,碳酸电离出碳酸根和氢离子,分别与钙离子和次氯酸跟结合,离子方程式正确,C正确;
D.题给四种离子可以大量共存,但加入少量硝酸时,由于亚硫酸根的还原性强于碘离子,故硝酸先与亚硫酸根发生反应,反应的离子方程式为3![]() +2
+2![]() + 2H+=3
+ 2H+=3![]() +2NO↑+H2O,D错误;
+2NO↑+H2O,D错误;
故选C。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
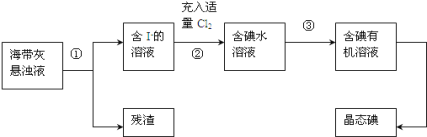
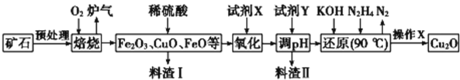
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为______。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。