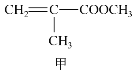
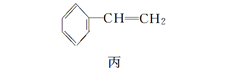
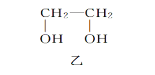题目内容
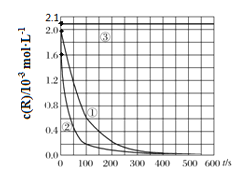
【题目】已知:8NH3(g) +6NO2(g) ![]() 7N2(g) +12H2O(1) △H<0。相同条件下,向2 L恒容密闭容器内充入一定量的NH3和NO2,分别选用不同的催化剂进行已知反应(不考虑NO2和N2O4之间的相互转化),反应生成N2的物质的量随时间的变化如图所示。下列说法错误的是( )
7N2(g) +12H2O(1) △H<0。相同条件下,向2 L恒容密闭容器内充入一定量的NH3和NO2,分别选用不同的催化剂进行已知反应(不考虑NO2和N2O4之间的相互转化),反应生成N2的物质的量随时间的变化如图所示。下列说法错误的是( )
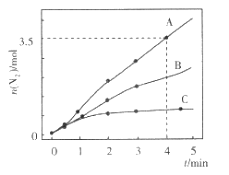
A.在催化剂A的作用下,0 ~4 min 内v(NH3)=1.0mol![]() L-1
L-1![]() min-1
min-1
B.若在恒容绝热的密闭容器中反应,当容器内温度不变时,说明反应已经达到平衡
C.不同催化剂作用下,该反应的活化能由大到小的顺序是Ea(C)> Ea(B)> Ea(A)
D.升高温度可使容器内气体颜色变浅
【答案】AD
【解析】
A.在催化剂A的作用下,0 ~4 min内v(NH3)=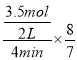 =0.5mol
=0.5mol![]() L-1
L-1![]() min-1,选项A错误;
min-1,选项A错误;
B.若在恒容绝热的密闭容器中反应,当容器内温度不变时,说明反应已经达到平衡,选项B正确;
C.相同时间内生成的N2越多,反应速率越快,说明反应的活化能越低,结合题图可知,不同催化剂作用下该反应的活化能由大到小的顺序是Ea(C) >Ea (B) >Ea(A),选项C正确;
D.升高温度可使平衡左移,使得二氧化氮浓度增大,容器内气体颜色加深,选项D错误。
答案选AD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列各组离子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式正确的是
选项 | 离子组 | 试剂X | 发生反应的离子方程式 |
A | K+、Na+、 | 少量HCl | H2O+H++ |
B |
| 少量H2S | Fe2++H2S=FeS↓+2H+ |
C | ClO-、Na+、Ca2+、 | 少量CO2 | CO2+Ca2++H2O+2ClO-=CaCO3↓+2HClO |
D | I-、Cl-、Na+、 | 少量稀硝酸 | 6I-+2 |
A.AB.BC.CD.D