题目内容
18.配制一定物质的量浓度的NaOH溶液时,造成实验结果偏高的是( )| A. | 定容摇匀后发现液面低于刻线,但没有补加 | |
| B. | 定容时观察液面俯视 | |
| C. | 有少量NaOH溶液残留在烧杯中 | |
| D. | 容量瓶中原来有少量蒸馏水 |
分析 根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:A、摇匀后液面低于刻度线是正常的,不加水是正确的,故对浓度无影响,故A错误;
B、定容时俯视液面,则溶液体积偏小,浓度偏高,故B正确;
C、有少量氢氧化钠残留在烧杯中,则溶质造成损失,浓度偏低,故C错误;
D、容量瓶中有水对溶液浓度无影响,故D错误.
故选B.
点评 本题考查了一定物质的量浓度溶液的配制过程中的误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
8.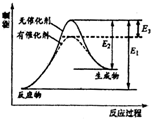 某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
 某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )| A. | 该反应为放热反应 | B. | 该反应的焓变△H=E3 | ||
| C. | 催化剂不能降低反应的活化能 | D. | 该反应逆反应的焓变△H=E2-E1 |
9.关于0.5molO2的下列说法正确的是( )
| A. | 体积为11.2L | B. | 摩尔质量是16g/mol | ||
| C. | 质量为32g | D. | 约含有6.02×1023个氧原子 |
6.铝、铍(Be)在元素周期表中的位置是对角线关系,具有相似的化学性质,下列说法正确的是( )
| A. | BeCl2水溶液导电性很强,故BeCl2是离子化合物 | |
| B. | Na2BeO2溶液PH>7,将其蒸干灼烧后得到固体BeO | |
| C. | 向Na2BeO2溶液中加入过量盐酸制备Be(OH)2 | |
| D. | Be(OH)2与NaOH反应的离子方程式为:Be(OH)2+2OH-═BeO22-+2H2O |
10.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
| A. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 | |
| B. | 1L lmol.L-1 FeBr2溶液与l mol氯气反应时转移的电子数为3NA | |
| C. | 标准状况下,11.2L HF所含的分子数约为3.01×1023 | |
| D. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA |
7.短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如表所示.下列说法中正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 化合价 | -2 | -3 | -4 | -2 |
| A. | 元素非金属性:甲<乙 | B. | 含氧酸的酸性:乙<丁 | ||
| C. | 氢化物的沸点:甲>丁 | D. | 丙所形成的单质可能互为同位素 |