题目内容
3.2009年8月17日卫生部办公厅印发了《饮水型地方性砷中毒监测方案(试行)的通知》.已知在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M,关于该反应的说法中正确的组合是( )①SnCl2是还原剂
②还原性:Cl->As
③每生成7.5gAs,还原剂失去的电子为0.3mol
④M为H2O
⑤SnCl62-是氧化产物.
| A. | ①②④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①③ |
分析 3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M,由原子守恒可知,M为H2O,Sn元素的化合价升高,As元素的化合价降低,结合氧化还原反应中还原剂的还原性大于还原产物的还原性及氧化剂的氧化性大于氧化产物的氧化性来解答.
解答 解:①Sn元素的化合价升高,则SnCl2是还原剂,故正确;
②Cl元素的化合价在该反应中不变,则不能比较Cl-、As的还原性,故错误;
③每生成7.5gAs,还原剂失去的电子为$\frac{7.5g}{75g/mol}$×(3-0)=0.3mol,故正确;
④由原子守恒可知,M为H2O,故正确;
⑤Sn失去电子被氧化,则SnCl62-是氧化产物,故正确;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | pH=6的溶液一定是酸性溶液 | |
| B. | 在等温等压条件下,能自发进行的化学反应,不一定是△H<0、△S>0 | |
| C. | 吸热反应一定需要加热才能发生,放热反应都能自发进行 | |
| D. | 弱电解质的电离常数既与弱电解质的性质和温度有关,也与溶液中的离子浓度有关 |
14.图表归纳是学习化学的一种常用方法.下列某同学归纳的表与图中对应关系正确的是( )
| 选项 | X | Y | Z | 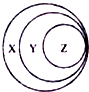 |
| A | 胶体 | 分散系 | 淀粉溶液 | |
| B | 强电解质 | 强酸 | 硫酸 | |
| C | 化合物 | 酸性氧化物 | 非金属氧化物 | |
| D | 离子反应 | 复分解反应 | 酸与盐的反应 |
| A. | A | B. | B | C. | C | D. | D |
18.配制一定物质的量浓度的NaOH溶液时,造成实验结果偏高的是( )
| A. | 定容摇匀后发现液面低于刻线,但没有补加 | |
| B. | 定容时观察液面俯视 | |
| C. | 有少量NaOH溶液残留在烧杯中 | |
| D. | 容量瓶中原来有少量蒸馏水 |
8.分类是科学研究的重要方法,下列物质分类不正确的是( )
| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 同素异形体:活性炭,C60,C80,金刚石 | |
| C. | 非电解质:乙醇,四氯化碳,氯气,葡萄糖 | |
| D. | 混合物:漂白粉,纯净矿泉水,盐酸,石灰石 |
12.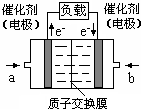 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )
 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )| A. | 右电极为电池正极,b处通入的物质是空气 | |
| B. | 左电极为电池负极,a处通入的物质是空气 | |
| C. | 负极反应式为:CH3OH+H2O-6e-=CO2+6H+ | |
| D. | 正极反应式为:O2+4H++4e-=2H2O |
13.下列操作不正确的是( )
| A. | 配制物质的量浓度的溶液,在定容时滴加蒸馏水超过刻度线,可用滴管吸出一部分使其溶液的凹液面与刻度线相切 | |
| B. | 过滤的时候,用玻璃棒引流,并将玻璃棒与三层滤纸的边缘接触 | |
| C. | 试管中滴加溶液时,不能将滴管伸入试管口内,应悬空滴入 | |
| D. | 蒸发氯化钠溶液,待蒸发皿中有大量固体出现时,停止加热,用余热蒸干 |