题目内容
6.铝、铍(Be)在元素周期表中的位置是对角线关系,具有相似的化学性质,下列说法正确的是( )| A. | BeCl2水溶液导电性很强,故BeCl2是离子化合物 | |
| B. | Na2BeO2溶液PH>7,将其蒸干灼烧后得到固体BeO | |
| C. | 向Na2BeO2溶液中加入过量盐酸制备Be(OH)2 | |
| D. | Be(OH)2与NaOH反应的离子方程式为:Be(OH)2+2OH-═BeO22-+2H2O |
分析 铝、铍(Be)在元素周期表中的位置是对角线关系,具有相似的化学性质,结合铝及铝的化合物的性质来解答.
解答 解:A.BeCl2与AlCl3的结构性质相似,属于共价化合物,可以利用熔融状态导电性判断是否属于离子化合物,故A错误;
B.Na2BeO2与NaAlO2性质相似,Na2BeO2属于强碱弱酸盐,溶液中BeO22-水解PH>7,将其蒸干过程中水解得到的氢氧化钠又与H2BeO2反应得到Na2BeO2,则蒸干Na2BeO2溶液并灼烧后得到的固体为Na2BeO2,故B错误;
C.氢氧化铝具有两性,则Be(OH)2既能溶于盐酸,又能溶于NaOH溶液,故C错误;
D.Be(OH)2与氢氧化铝性质相似,Be(OH)2与NaOH反应的离子方程式为:Be(OH)2+2OH-═BeO22-+2H2O,故D正确,
故选:D.
点评 本题考查结构性质位置关系应用,掌握对角线规则及性质的相似性为解答的关键,侧重考查学生对已有知识的迁移运用,题目难度中等.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
17.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 15g 甲基中含有的电子数为10NA | |
| B. | 标准状况下,以任意比例混合的甲烷和丙烷混合物22.4L,所含有的分子数为NA | |
| C. | 标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| D. | 在1L 1mol/L 的盐酸溶液中,所含氯化氢分子数为NA |
14.图表归纳是学习化学的一种常用方法.下列某同学归纳的表与图中对应关系正确的是( )
| 选项 | X | Y | Z | 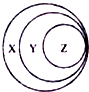 |
| A | 胶体 | 分散系 | 淀粉溶液 | |
| B | 强电解质 | 强酸 | 硫酸 | |
| C | 化合物 | 酸性氧化物 | 非金属氧化物 | |
| D | 离子反应 | 复分解反应 | 酸与盐的反应 |
| A. | A | B. | B | C. | C | D. | D |
1.少量铁粉与100mL 0.01mol•L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦把反应器敞开放入100℃水浴中 ⑧改用10mL 0.1mol/L盐酸( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦把反应器敞开放入100℃水浴中 ⑧改用10mL 0.1mol/L盐酸( )
| A. | ①⑥⑦ | B. | ③⑧ | C. | ③⑦⑧ | D. | ⑦⑧ |
18.配制一定物质的量浓度的NaOH溶液时,造成实验结果偏高的是( )
| A. | 定容摇匀后发现液面低于刻线,但没有补加 | |
| B. | 定容时观察液面俯视 | |
| C. | 有少量NaOH溶液残留在烧杯中 | |
| D. | 容量瓶中原来有少量蒸馏水 |
16.在室温下,由水电离出的C(H+)=10-12mol/L的溶液中,下列离子组可大量共存的是( )
| A. | K+、ClO-、SO42-、I- | B. | S2-、SO32-、Na+、K+ | ||
| C. | Fe2+、NO3-、Cl-、K+ | D. | AlO2-、MnO4-、Fe2+、Na+ |
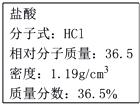 学会配制一定物质的量浓度的溶液具有重要意义.某同学欲用下图试剂瓶标签上某浓度的盐酸配制450mL 0.4mol/L的稀盐酸.
学会配制一定物质的量浓度的溶液具有重要意义.某同学欲用下图试剂瓶标签上某浓度的盐酸配制450mL 0.4mol/L的稀盐酸.