题目内容
5.下列叙述中,正确的是( )| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与比它原子序数小的稀有气体元素原子的核外电子排布相同 |
分析 A.两种微粒,若核外电子排布完全相同,则化学性质不一定相同,可能是两种离子;
B.由单原子形成的离子,不一定具有稀有气体元素原子核外电子排布;
C.原子中核外电子数=核内质子数,元素是具有相同质子数的同一类原子;
D.阴离子的核外电子排布与同一周期稀有气体原子核外排布相同.
解答 解:A.两种微粒,若核外电子排布完全相同,则化学性质不一定相同,可能是两种离子,如Na+和O2-,故A错误;
B.由单原子形成的离子,不一定具有稀有气体元素原子核外电子排布,如H+,故B错误;
C.原子中核外电子数=核内质子数,元素是具有相同质子数的同一类原子,所以两原子,如果核外电子排布相同,则一定属于同一种元素,故C正确;
D.阴离子的核外电子排布与同一周期稀有气体原子核外排布相同,主族金属元素阳离子的核外电子排布一定与上一周期稀有气体原子核外排布相同,故D错误;
故选C.
点评 本题考查了原子结构和性质,根据原子结构采用反例法分析解答,注意规律中的异常现象,题目难度中等.

练习册系列答案
相关题目
15.下表为元素周期表的一部分,请回答有关问题:
(1)①和⑤的元素符号是N和Si.
(2)表中最活泼的金属是K,非金属性最强的元素是F.(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al(填写元素符号),分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,Al(OH)3+KOH=KAlO2+2H2O.
(4)⑦和⑩元素形成单质的氧化性的强弱为Cl2>Br2.(用化学符号表示)证明该结论的一个实验事实(用离子方程式表示)Cl2+2Br-=2Cl-+Br2.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属性最强的元素是F.(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al(填写元素符号),分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,Al(OH)3+KOH=KAlO2+2H2O.
(4)⑦和⑩元素形成单质的氧化性的强弱为Cl2>Br2.(用化学符号表示)证明该结论的一个实验事实(用离子方程式表示)Cl2+2Br-=2Cl-+Br2.
16.下列关于硅及其化合物的叙述正确的是( )
| A. | 28Si、29Si、30Si是同素异形体 | |
| B. | 自然界里存在大量的单质硅、二氧化硅和硅酸盐 | |
| C. | 硅和锗都是重要的半导体材料 | |
| D. | 二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物 |
13.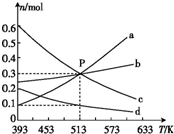 在1L恒容密闭容器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,平衡时各物质的物质的量与温度的关系如图所示,下列说法正确的是( )
在1L恒容密闭容器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,平衡时各物质的物质的量与温度的关系如图所示,下列说法正确的是( )
 在1L恒容密闭容器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,平衡时各物质的物质的量与温度的关系如图所示,下列说法正确的是( )
在1L恒容密闭容器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,平衡时各物质的物质的量与温度的关系如图所示,下列说法正确的是( )| A. | △H<0 | |
| B. | 图中曲线a表示H2(g)的变化 | |
| C. | P点时,平衡常数值约为333.3 | |
| D. | 513 K时,向上述容器中充入n(H2)=0.6 mol,n(CO2)=0.2 mol,n(C2H4)=0.6 mol,n(H2O)=0.6 mol,则达到平衡时氢气的体积分数比P点时的小 |
20.下列关于反应速率的说法正确的是( )
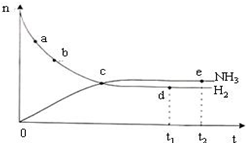

| A. | 决定反应速率的主要因素是反应物的浓度 | |
| B. | 化学反应速率为0.8 mol/(L•s) 是指1s 时某物质的浓度为0.8mol/L | |
| C. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| D. | 如图表示密闭容器中673 K,30 MPa下的反应:N2(g)+3H2(g)?2NH3(g)△H<0,n(NH3)和n(H2)随时间变化的关系曲线图.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
14.人类使用材料的增多和变化,标志着人类文明的进步,下列材料与化学制备无关的是( )
| A. | 铁器 | B. | 石器 | C. | 青铜器 | D. | 合成材料 |
 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.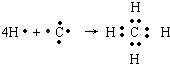 .
.
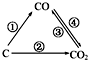 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.