题目内容
15.下表为元素周期表的一部分,请回答有关问题:| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属性最强的元素是F.(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al(填写元素符号),分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,Al(OH)3+KOH=KAlO2+2H2O.
(4)⑦和⑩元素形成单质的氧化性的强弱为Cl2>Br2.(用化学符号表示)证明该结论的一个实验事实(用离子方程式表示)Cl2+2Br-=2Cl-+Br2.
分析 (1)由元素在周期表中的位置可知,①是N,②是F,③是Mg,④是Al,⑤是Si,⑥是S,⑦是Cl,⑧是Al,⑨是K,⑩是Br;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;
(3)铝元素形成的氢氧化铝属于两性氢氧化物,⑥、⑨最高价氧化物的水化物分别为H2SO4、KOH,氢氧化铝与硫酸反应生成硫酸铝与水,与氢氧化钠反应生成偏铝酸钠与水;
(4)同主族自上而下非金属性减弱,单质的氧化性减弱,可以利用单质之间的相互置换反应证明.
解答 解:(1)由元素在周期表中的位置可知,①是N,②是F,③是Mg,④是Al,⑤是Si,⑥是S,⑦是Cl,⑧是Al,⑨是K,⑩是Br,
故答案为:N;Si;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中K的金属性最强,F的非金属性最强,
故答案为:K;F;
(3)Al元素形成的氢氧化铝属于两性氢氧化物,⑥、⑨最高价氧化物的水化物分别为H2SO4、KOH,氢氧化铝与硫酸反应生成硫酸铝与水,与氢氧化钾反应生成偏铝酸钾与水,反应方程式为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O、Al(OH)3+KOH=KAlO2+2H2O,
故答案为:Al;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;Al(OH)3+KOH=KAlO2+2H2O;
(4)同主族自上而下非金属性减弱,单质的氧化性减弱,故Br2的氧化性较弱,即氧化性Cl2>Br2,可以利用单质之间的相互置换反应证明,离子方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2>Br2;Cl2+2Br-=2Cl-+Br2.
点评 本题考查元素周期表与元素周期律,难度不大,知道金属性、非金属性强弱判断方法,难点是氧化性强弱比较方法的实验设计.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案| A. | 431 kJ•mol-1 | B. | 307 kJ•mol-1 | C. | 730 kJ•mol-1 | D. | 370 kJ•mol |

回答下列问题:
(1)反应炉中发生反应的化学方程式为2Fe+3Cl2=2FeCl3 .
(2)己知FeCl3•6H20在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/l00gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的化学式为Fe2Cl6.
(4)吸收塔中吸收剂X的作用是吸收反应炉中过量的氯气和少量氯化铁烟气,FeCl3溶液可腐蚀印刷电路铜板,其离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(5)室温时向FeCl3溶液中滴加NaOH溶液,当溶液中c(Fe3+)≤l.O×lO-5mol•L-1时,视作Fe3+沉淀完全,则Fe3+沉淀完全的pH至少为3(已知Ksp[Fe(OH)3]=l.0×l0-38).
| A. | 4种 3种 | B. | 4种 2种 | C. | 3种 3种 | D. | 3种 2种 |
干海带$\stackrel{焙烧}{→}$海带灰$\stackrel{水}{→}$水溶液$\stackrel{氧化}{→}$$\stackrel{A}{→}$$\stackrel{B}{→}$→碘单质
下列有关叙述不正确的是( )
| A. | 碘元素在海水中没有游离态存在 | |
| B. | 在提取的过程中用的氧化剂可以是H2O2 | |
| C. | 操作A是萃取 | |
| D. | B是提纯操作,常用蒸馏 |
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与比它原子序数小的稀有气体元素原子的核外电子排布相同 |
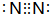 ;用电子式表示D2A的形成过程
;用电子式表示D2A的形成过程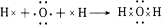 .
.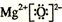 .
.