题目内容
17.据2002年3月5日的《环球时报》报道:意大利警方一举摧毁了四名摩洛哥人针对美国驻意大利大使馆的恐怖事件.警方从摩洛哥人的住宅中搜出了5kg爆竹,2.5kg蜡烛和2kg K4[Fe(CN)6].据审讯,四名恐怖分子准备将爆竹作炸药,蜡烛作引爆剂,K4[Fe(CN)6]在爆炸中可分解成一种剧毒盐KCN.试根据要求回答下列问题:
(1)已知爆竹爆炸后,K4[Fe(CN)6]会发生分解,除生成剧毒盐KCN外,还生成三种稳定的单质.试写出化学反应方程式:K4[Fe(CN)6]═4KCN+Fe+N2↑+2C.
(2)恐怖分子打算将产生的剧毒盐KCN用来污染水源,含CN-的污水危害很大.处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-.CNO-在酸性条件下继续被NaClO氧化生成N2与CO2.某环保部门用右图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率.
将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞.
①甲中反应的离子方程式为CN-+ClO-=CNO-+Cl-;乙中反应的离子方程式为2CNO-+3ClO-+2H+=N2↑+2CO2↑+H2O+3Cl-.
②乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN-的处理效果.丙中加入的除杂试剂是A(填标号).
(A)饱和食盐 (B)饱和NaHCO3溶液 (C)浓NaOH溶液 (D)浓硫酸
丁在实验中的作用是除去混合气体中Cl2,防止对CO2测定量的影响.戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN-被处理的百分率>80%(填“>”、“二”或“<”=.
分析 (1)K4[Fe(CN)6]会发生分解,除生成剧毒盐KCN外,还生成三种稳定的单质,由元素守恒可知,单质为Fe、C、氮气;
(2)①CN-的废水在催化剂TiO2作用下用NaClO氧化,使CN-转化成CNO-,还生成氯离子;CNO-在酸性条件下继续被NaClO氧化成N2与CO2,还生成氯离子、水;
②饱和食盐水除去氯化氢气体,铜网用来除去氯气,根据碳原子守恒,计算出被处理的CN-的物质的量,再利用200mL(其中CN-的浓度0.05mol/L)求出CN-被处理的百分率分析判断.
解答 解:(1)K4[Fe(CN)6]会发生分解,除生成剧毒盐KCN外,还生成三种稳定的单质,由元素守恒可知,单质为Fe、C、氮气,由质量守恒定律可知该反应为K4[Fe(CN)6]═4KCN+Fe+N2↑+2C,
故答案为:K4[Fe(CN)6]═4KCN+Fe+N2↑+2C;
(2)①CN-的废水在催化剂TiO2作用下用NaClO氧化,使CN-转化成CNO-,还生成氯离子,离子反应为CN-+ClO-═CNO-+Cl-,CNO-在酸性条件下继续被NaClO氧化成N2与CO2,还生成氯离子、水,离子反应为2CNO-+3ClO-+2H+═N2+2CO2+3Cl-+H2O,
故答案为;CN-+ClO-=CNO-+Cl-,2CNO-+3ClO-+2H+═N2+2CO2+3Cl-+H2O;
②乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,
(A)、饱和食盐水能够除去氯化氢杂质,故A正确;
(B)饱和NaHCO3溶液和氯化氢反应生成二氧化碳对二氧化碳的测定,故B错误;
(C)浓NaOH溶液能吸收氯化氢和二氧化碳,不能测定CO2的量来确定CN-的处理效果,故C错误;
(D)浓硫酸不能吸收氯化氢,对测定二氧化碳产生影响,故D错误,
故选A,
铜网能够和氯气反应从而除去氯气杂质,丁在实验中的作用是除去混合气体中Cl2,防止对CO2测定量的影响,
200mL(其中CN-的浓度0.05mol/L)混合液中含有的CN-的物质的量是:0.2L×0.05mol/L=0.01mol,根据碳原子守恒,增多生成0.01mol二氧化碳,所以石灰水过量,生成的碳酸钙的物质的量是:0.0082mol,反应的CN-的物质的量是0.0082mol,CN-被处理的百分率是:$\frac{0.0082mol}{0.01mol}$×100%=82%>80%,
故答案为:A;除去混合气体中Cl2,防止对CO2测定量的影响,>.
点评 本题考查了电镀后的废水中CN-离子的含量测定,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力,侧重氧化还原反应方程式书写的考查,注意判断发生的氧化还原反应,题目难度不大.

| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与比它原子序数小的稀有气体元素原子的核外电子排布相同 |
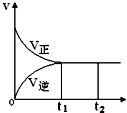 可逆反应N2(g)+3H2(g)?2NH3(g),正反应为放热反应,在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述错误的是( )
可逆反应N2(g)+3H2(g)?2NH3(g),正反应为放热反应,在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述错误的是( )| A. | t1~t2,各物质的浓度不再发生变化 | |
| B. | t2时刻升高温度,反应物转化率不会改变 | |
| C. | t2时刻增大N2的浓度,可提高H2的转化率 | |
| D. | 使用催化剂可加快反应速率,提高生产效率 |
| A. | AgNO3 溶液中加入Cu:Cu+Ag+=Cu2++Ag | |
| B. | NaHCO3溶液中加入CH3COOH:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O | |
| C. | 含0.2mol FeBr2 的溶液中通入0.2mol Cl2:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
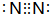 ;用电子式表示D2A的形成过程
;用电子式表示D2A的形成过程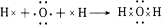 .
.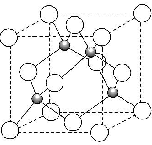 2014 年10 月7 日,赤崎勇、天野浩和中村修二因发明“高亮度蓝色发光二极管(LED)”获得2014 年诺贝尔物理学奖.制作LED 首先在衬底上制作氮化镓(GaN)基的外延片,常用的衬底主要有蓝宝石(Al2O3)、碳化硅和硅,还有砷化镓(GaAs)、AlN、ZnO 等材料.回答下列问题:
2014 年10 月7 日,赤崎勇、天野浩和中村修二因发明“高亮度蓝色发光二极管(LED)”获得2014 年诺贝尔物理学奖.制作LED 首先在衬底上制作氮化镓(GaN)基的外延片,常用的衬底主要有蓝宝石(Al2O3)、碳化硅和硅,还有砷化镓(GaAs)、AlN、ZnO 等材料.回答下列问题: