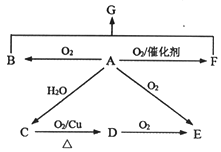
题目内容
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是
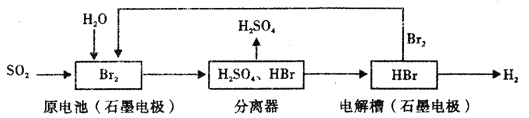
A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
【答案】D
【解析】A项,分析流程:SO2、Br2和H2O反应生成HBr和H2SO4,然后分离HBr和H2SO4,最后电解HBr溶液得到Br2和H2,结合流程可得,该生产工艺中Br2被循环利用,故A正确;B项,电解HBr溶液,阴极H+得电子生成H2,消耗H+,在电解过程中,电解槽阴极附近溶液的pH变大,故B正确;C项,原电池中负极发生失电子氧化反应,电极反应式为:SO2+2H2O-2e-=SO42-+4H+,故C正确;D项,该工艺是以SO2为原料,制备H2SO4和H2,总反应为:SO2+2H2O=H2SO4+H2,故D正确。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目