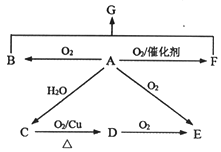
题目内容
【题目】短周期元素R、X、Y、Z在元素周期表中的相对位置如图所示,X原子最外层电子数比次外层电子数少3,下列说法正确的是
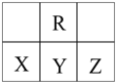
A.X的气态氢化物比R的气态氢化物稳定
B.原子半径大小顺序是:r(Z)> r( Y) > r( X)
C.Y、R形成的化合物YR2能使酸性KMnO4溶液褪色
D.X、Z形成的化合物XZ5中各原子均满足最外层8电子结构
【答案】C
【解析】
由短周期元素R、X、Y、Z在元素周期表中的相对位置可知,R处于第二周期,X、Y、Z处于第三周期.X原子最外层电子数比次外层电子数少3,故X最外层电子数为8-3=5,故X为磷元素,则Y为硫元素、Z为Cl元素、R为氧元素;
由分析知:X为磷元素、Y为硫元素、Z为Cl元素、R为氧元素;
A.同周期自左而右元素的非金属性增强,同主族自上元素非金属减弱,故非金属性R>X,非金属性越强氢化物越稳定,故R的气态氢化物更稳定,故A错误;
B.同周期自左而右原子半径减小,故原子半径X>Y>Z,故B错误;
C.SO2具有较强还原性,能被酸性KMnO4氧化,使KMnO4溶液褪色,故C正确;
D.PCl5分子中P原子分别与5个Cl之间形成1个电子对,P原子最外层共有10电子,Cl原子满足最外层8电子结构,故D错误;
故答案为C。

【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(H+) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的逆反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大