题目内容
1.在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g)?SO3(g)+NO(g).当达到平衡状态时,测得容器中SO2(g)的转化率为50%.(1)该温度下的该反应的平衡常数=1(用数值表示)
(2)该温度下、该容器中,再继续加入1mol的SO2(g),则:
①化学平衡将向正反应方向移动,NO2的转化率将增大;
②经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是0.18mol/L.
分析 (1)在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,转化的SO2为2mol×50%=1mol,则:
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol):2 2 0 0
转化量(mol):1 1 1 1
平衡量(mol):1 1 1 1
再根据K=$\frac{c(S{O}_{3})×c(NO)}{c(S{O}_{2})×c(N{O}_{2})}$计算平衡常数;
(2)①该温度下、该容器中,再继续加入1mol的SO2(g),平衡正向移动;
②等效为开始加入3mol的SO2(g)和2mol的NO2(g),设平衡时容器中SO2(g)的浓度是xmol/L,表示出其它组分的平衡浓度,再根据平衡常数列方程计算.
解答 解:(1)在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,转化的SO2为2mol×50%=1mol,则:
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol):2 2 0 0
转化量(mol):1 1 1 1
平衡量(mol):1 1 1 1
平衡常数K=$\frac{c(S{O}_{3})×c(NO)}{c(S{O}_{2})×c(N{O}_{2})}$=$\frac{0.1×0.1}{0.1×0.1}$=1,
故答案为:1;
(2)①该温度下、该容器中,再继续加入1mol的SO2(g),平衡向正反应方向移动,NO2的转化率增大,
故答案为:正反应;增大;
②等效为开始加入3mol的SO2(g)和2mol的NO2(g),设平衡时容器中SO2(g)的浓度是xmol/L,则:
SO2(g)+NO2(g)?SO3(g)+NO(g)
起始量(mol/L):0.3 0.2 0 0
转化量(mol/L):0.3-x 0.3-x 0.3-x 0.3-x
平衡量(mol/L):x x-0.1 0.3-x 0.3-x
所以$\frac{(0.3-x)×(0.3-x)}{x×(x-0.1)}$=1,解得x=0.18,
故答案为:0.18.
点评 本题考查化学平衡有关计算,涉及平衡常数计算及应用,掌握三段式解题法,注意平衡常数有关应用.

| A. | S(s)+3C(s)+2KNO3(s)=N2(g)+3CO2(g)+K2S(s) | B. | 2NO(g)+O2(g)=2NO2(g) | ||
| C. | 2CO(g)=C(s)+CO2(g) | D. | 2SO2(g)+O2(g)=2SO3(g) |
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 0~4s容器内的压强逐渐增大 | |
| B. | 生成Cl2的平均反应速率,0~2s比2~4s快 | |
| C. | 8s时向容器中再充入一定量的氦气,反应速率又会加快 | |
| D. | 该条件下,COCl2的最大转化率为40% |
| A. | 实验室中用生石灰与浓氨水混合的方法不能制得氨气 | |
| B. | 中和滴定实验中,所用滴定管和锥形瓶均不能用待装液润洗 | |
| C. | 在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的1/3 | |
| D. | 将KI和FeCl3溶液混合后,加入CCl4振荡静置,下层液体变紫色,说明氧化性:Fe3+>I2 |
 1,2,3,4-四氢化萘的结构简式是
1,2,3,4-四氢化萘的结构简式是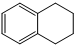 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下: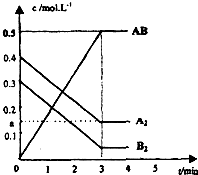 在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.