题目内容
17.锌锰废电池可回收锌、锰元素生产硫酸锌及碳酸锰,其中生产碳酸锰的主要工艺如下: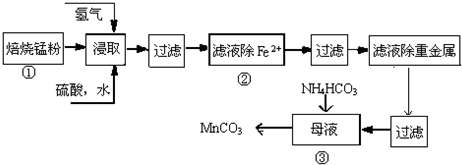
试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明Zn2++2H2O?Zn(OH)2+2H+.
(2)原料锰粉粗品中主要成分为MnO2和炭,在过程①焙烧时反应的化学方程式为MnO2+C═MnO+CO↑,该反应的氧化产物是CO,每生成44.8L(标准状况下)气体时转移电子数为4NA.
(3)在50~55℃时向过程③中MnSO4的母液中加入足量NH4HCO3,有气体生成,其化学方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7. Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | 2Fe2++H2O2+2H+=2Fe3++2H2O |
| 步骤2:将pH调到3.7~8.6,使Fe3+沉淀完全. | Fe3++3H2O?Fe(OH)3+3H+ |
分析 原料锰粉粗品的主要成分为MnO2和碳,焙烧时碳被MnO2氧化为一氧化碳,碳把二氧化锰还原为一氧化锰,通入氢气还原一氧化锰得到锰单质,加入硫酸生成硫酸锰、硫酸亚铁,过滤,滤液中含亚铁离子、锰离子.由题给离子沉淀PH可知,除亚铁离子,需先用氧化剂氧化亚铁离子变成铁离子,再调节PH使铁离子沉淀,而锰离子不沉淀,过滤后滤液中含锰离子,加入碳酸氢铵得到碳酸锰沉淀,过滤洗涤干燥得成品碳酸锰,
(1)依据锌离子水解显酸性分析;
(2)根据化学方程式为MnO2+C═MnO+CO↑,可知,碳被二氧化锰氧化成CO,在该反应中每转移1molCO,反应中转移2mol电子,据此计算;
(3)根据流程可知,在50~55℃时向过程③中MnSO4的母液中加入足量NH4HCO3,生成碳酸锰及气体应为二氧化碳,根据元素守恒书写化学方程式;
(4)调节溶液PH使铁离子完全沉淀,锰离子不沉淀的溶液PH;根据离子开始沉淀和沉淀完全的PH分析回答.
解答 解:原料锰粉粗品的主要成分为MnO2和碳,焙烧时碳被MnO2氧化为一氧化碳,碳把二氧化锰还原为一氧化锰,通入氢气还原一氧化锰得到锰单质,加入硫酸生成硫酸锰、硫酸亚铁,过滤,滤液中含亚铁离子、锰离子.由题给离子沉淀PH可知,除亚铁离子,需先用氧化剂氧化亚铁离子变成铁离子,再调节PH使铁离子沉淀,而锰离子不沉淀,过滤后滤液中含锰离子,加入碳酸氢铵得到碳酸锰沉淀,过滤洗涤干燥得成品碳酸锰,
(1)锌离子水解生成氢氧化锌和氢离子,溶液呈酸性,反应的离子方程式为:Zn2++2H2O?Zn(OH)2+2H+,
故答案为:Zn2++2H2O?Zn(OH)2+2H+;
(2)根据化学方程式为MnO2+C═MnO+CO↑,可知,碳被二氧化锰氧化成CO,所以反应的氧化产物是CO,在该反应中每生成1molCO,反应中转移2mol电子,所以生成44.8L(标准状况下)即2mol气体时转移电子数为4NA,
故答案为:CO;4;
(3)50-55℃向MnS04的母液中加入足量NH4HC03,依据实验目的得到碳酸锰,依据原子守恒得到产物还有:硫酸铵、二氧化碳和水,反应的方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑;
故答案为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑;
(4)三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6.过程②是除去亚铁离子的方法,加入氧化剂过氧化氢盐亚铁离子为铁离子,调节溶液PH在3.7~8.6,铁离子完全沉淀,锰离子不沉淀,达到分离杂质的目的;过氧化氢氧化亚铁离子的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;3.7~8.6.
点评 本题考查了物质制备方案的设计流程分析判断,离子性质和检验的应用调节溶液PH除去杂质离子是解题关键,题目难度中等.


| A. | N2(g)+3H2(g)?2NH3(g)△H<0 | B. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | C(s)+H2O(g)?H2(g)+CO(g)△H>0 |
| A. | 碘化钾 | B. | 硝酸银 | C. | 溴化钠 | D. | 液氯 |

回答下列问题:
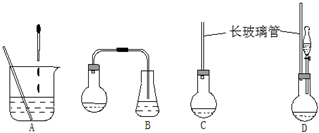
(1)检查装置气密性的方法是在仪器D的出气口连接导管,将导管的末端插入水槽中的水中,用酒精灯轻轻加热圆底烧瓶,若导管口有气泡冒出且停止加热后,在导管中形成一段水柱,说明装置气密性良好,a仪器的名称是分液漏斗
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O;
(3)装置B的作用是除去氧气(及氮氧化物),装置C的作用是除去水蒸气;
(4)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
(5)实验室中某些气体的制取、收集及尾气处理装置如图2所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Fe | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
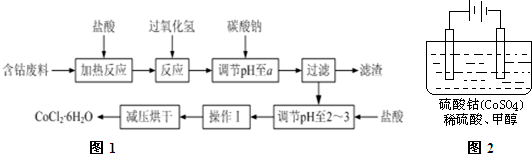
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.5 | 7.6 | 3.8 |
| 完全沉淀 | 3.2 | 9.7 | 9.2 | 5.2 |
(1)加入碳酸钠调节pH至a,a的范围是5.2~7.6.
(2)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(3)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(4)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染、防止产品中混有硝酸盐.原工艺较新工艺也有优点,其主要优点是流程的步骤减小,工艺减化.
(5)含钴物质在工业上有重要用途,有一种电化学法除去甲醇的污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中甲醇氧化成CO2而净化.实验室用如图2装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+.
②除去甲醇的离子反应为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是碳元素,当生产过程中产生标况下2.24LCO2时,共转移电子数为3.612×1023.
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 0~4s容器内的压强逐渐增大 | |
| B. | 生成Cl2的平均反应速率,0~2s比2~4s快 | |
| C. | 8s时向容器中再充入一定量的氦气,反应速率又会加快 | |
| D. | 该条件下,COCl2的最大转化率为40% |
| A. | 将温度迅速升高20℃,两溶液的pH均增大 | |
| B. | 加水稀释相同倍数后,两溶液的pH同等程度减小 | |
| C. | 加少量的醋酸钠固体后,两溶液的pH均增大 | |
| D. | 加足量的锌充分反应后,两溶液产生的氢气的量一样多 |
 1,2,3,4-四氢化萘的结构简式是
1,2,3,4-四氢化萘的结构简式是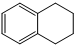 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下: