题目内容
14.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).反应过程中测定的部分数据见下表(表中t1>t2),则下列说法正确的是( )| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率减小 | |
| D. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol |
分析 A.由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(CO),再根据速率之比等于化学计量数之比计算v(H2);
B.t1min时n(CO)=0.8mol,则n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据平衡时各物质的浓度计算原平衡常数,比较不同温度下的平衡常数大小可判断反应的吸热与放热问题;
C.保持其他条件不变,增加一种反应物的浓度,平衡向正反应方向移动,另一种反应物的转化率增大,自身转化率降低;
D.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O到达平衡时对应生成物的浓度、物质的量相同.
解答 解:A.由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,则v(CO)=$\frac{\frac{0.4mol}{2L}}{{t}_{1}}$$\frac{\frac{0.4mol}{2L}}{{t}_{1}min}$=$\frac{0.2}{{t}_{1}}$mol/(L•min),速率之比等于化学计量数之比,则v(H2)=v(CO)=$\frac{0.2}{{t}_{1}}$mol/(L•min),故A错误;
B.t1min时n(CO)=0.8mol,则n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,此时c(CO)=$\frac{0.8mol}{2L}$=0.4mol/L,c(H2O)=$\frac{0.2mol}{2L}$=0.1mol/L,由方程式可知n(CO2)=n(H2)=△n(CO)=0.40 mol,故c(CO2)=c(H2)=$\frac{0.4mol}{2L}$=0.2mol/L,则K=$\frac{0.2×0.2}{0.4×0.1}$=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动,故正反应应为放热反应,故B错误;
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,故C错误;
D.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,到达平衡时n(CO2)=△n(CO)=0.40 mol,故D正确,
故选:D.
点评 本题考查化学反应速率、化学平衡及平衡常数等计算,注意D选项中的规律利用,也可以利用平衡常数计算解答.

| A. | 用玻璃棒蘸取某未知溶液进行焰色反应,若火焰颜色为黄色则说明一定有钠元素 | |
| B. | 某未知溶液加稀氢氧化钠溶液,未产生能使湿润红色石蕊试纸变蓝的气体,则说明原溶液不含NH${\;}_{4}^{+}$ | |
| C. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| D. | 某溶液加入盐酸,无明显现象,再加BaCl2溶液,产生白色沉淀,则说明溶液中一定有 SO${\;}_{4}^{2-}$ |

回答下列问题:
(1)检查装置气密性的方法是在仪器D的出气口连接导管,将导管的末端插入水槽中的水中,用酒精灯轻轻加热圆底烧瓶,若导管口有气泡冒出且停止加热后,在导管中形成一段水柱,说明装置气密性良好,a仪器的名称是分液漏斗
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O;
(3)装置B的作用是除去氧气(及氮氧化物),装置C的作用是除去水蒸气;
(4)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
(5)实验室中某些气体的制取、收集及尾气处理装置如图2所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Fe | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
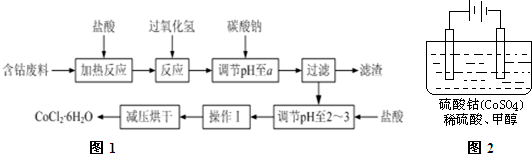
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.5 | 7.6 | 3.8 |
| 完全沉淀 | 3.2 | 9.7 | 9.2 | 5.2 |
(1)加入碳酸钠调节pH至a,a的范围是5.2~7.6.
(2)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(3)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(4)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染、防止产品中混有硝酸盐.原工艺较新工艺也有优点,其主要优点是流程的步骤减小,工艺减化.
(5)含钴物质在工业上有重要用途,有一种电化学法除去甲醇的污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中甲醇氧化成CO2而净化.实验室用如图2装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+.
②除去甲醇的离子反应为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是碳元素,当生产过程中产生标况下2.24LCO2时,共转移电子数为3.612×1023.
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 0~4s容器内的压强逐渐增大 | |
| B. | 生成Cl2的平均反应速率,0~2s比2~4s快 | |
| C. | 8s时向容器中再充入一定量的氦气,反应速率又会加快 | |
| D. | 该条件下,COCl2的最大转化率为40% |
H2O2+I-→H2O+IO- 慢
H2O2+IO-→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
| A. | I-是该反应的催化剂 | B. | IO-也是该反应的催化剂 | ||
| C. | 反应活化能等于98 kJ•mol-1 | D. | v(H2O2)=v(H2O)=v(O2) |
 A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同.已知:2NO2(g)?N2O4(g)△H<0.
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同.已知:2NO2(g)?N2O4(g)△H<0. 1,2,3,4-四氢化萘的结构简式是
1,2,3,4-四氢化萘的结构简式是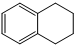 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2?C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水.有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下: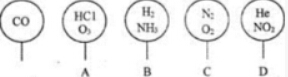 取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,吹出体积相等的状况,如图所示.A、B、C、D四个气球内,与CO所含原子数一定相等的是( )
取五个相同的气球,同温同压下,分别充入CO和以下四种混合气体,吹出体积相等的状况,如图所示.A、B、C、D四个气球内,与CO所含原子数一定相等的是( )