题目内容
16.某同学对“NaOH和NH4Cl都是离子化合物”,有下列四点感悟,其中错误的是( )| A. | 离子化合物中可能含共价键 | B. | 碱和铵盐都是离子化合物 | ||
| C. | 离子化合物中不一定含金属元素 | D. | 离子化合物中一定含离子键 |
分析 A.离子化合物中一定含有离子键,可能含有共价键;
B.部分碱和铵盐是离子化合物,但部分碱是共价化合物;
C.离子化合物中可能只含非金属元素;
D.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键.
解答 解:A.离子化合物中一定含有离子键,可能含有共价键,如铵盐、NaOH等,故A正确;
B.部分碱和铵盐是离子化合物,但部分碱是共价化合物,如一水合氨(NH3.H2O)属于碱但是共价化合物,故B错误;
C.离子化合物中可能只含非金属元素,如铵盐,故C正确;
D.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,如铵盐等,故D正确;
故选B.
点评 本题考查离子化合物和共价化合物判断,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,采用举例法分析解答,易错选项是C.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
7.下列过程中,共价键被破坏的是( )
| A. | 溴挥发 | B. | 氯气被木炭吸附 | C. | 食盐溶于水 | D. | 硫酸溶于水 |
4.化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| B. | 石油干馏可得到石油气、汽油、煤油、柴油等 | |
| C. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| D. | 制作快餐盒的聚苯乙烯塑料是易降解塑料 |
11.今有五种有机物:
①CH2OH(CHOH)4CHO
②CH3(CH2)3OH
③CH2═CH-CH2OH
④CH2═CH-COOCH3
⑤CH2═CH-COOH.
其中既能发生加成反应、加聚反应、酯化反应,又能发生氧化反应的是( )
①CH2OH(CHOH)4CHO
②CH3(CH2)3OH
③CH2═CH-CH2OH
④CH2═CH-COOCH3
⑤CH2═CH-COOH.
其中既能发生加成反应、加聚反应、酯化反应,又能发生氧化反应的是( )
| A. | ③⑤ | B. | ①②⑤ | C. | ②④ | D. | ③④ |
5.如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
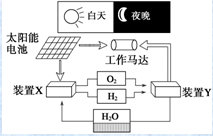

| A. | 装置X能实现燃料电池的燃料和氧化剂再生 | |
| B. | 装置Y中负极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 该系统中只存在3种形式的能量转化 | |
| D. | 装置X、Y形成的子系统能实现物质零排放,并能实现化学能与电能间的完全转化 |
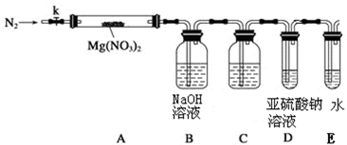 某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
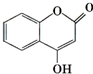 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: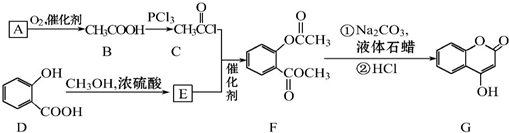
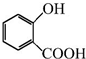 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$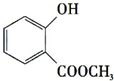 +H2O.
+H2O. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.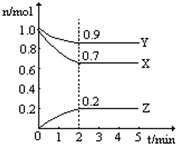 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: