题目内容
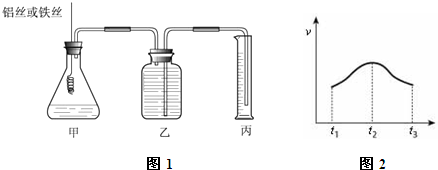
1.某研究小组为比较Al和Fe的金属性强弱,设计了图1所示的装置,甲中锥形瓶内盛放的是100ml稀盐酸(反应前后溶液体积变化可以忽略不计).(1)若要比较产生气体的快慢有两种方法,一种是比较产生相同体积气体所需的时间,另一种是比较相同时间内产生气体体积大小;
(2)为了确保“Al和Fe的金属活动性不同是导致产生气体速率不同的唯一原因”,实验时需要控制好反应条件.实验时除需保证甲中液体的体积、物质的量浓度和温度相同外,还需保证Al和Fe表面积相同;
(3)实验测得产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间内速率逐渐加快说明该反应是放热(填放热或吸热)反应,t2~t3时间内速率逐渐减慢的主要原因是盐酸浓度不断减小;
(4)如果在相同条件下,把甲锥形瓶内盛放稀盐酸改成H+浓度相同的稀硫酸,发现反应会比原来慢许多,原因可能是Cl-会促进该反应的进行,(或SO42-抑制该反应的进行).
分析 (1)根据v=$\frac{△V}{△t}$分析;
(2)由外界条件对化学反应速率的影响分析;
(3)由外界条件对化学反应速率的影响分析;
(4)盐酸和稀硫酸具有相同的阳离子H+,稀盐酸改成H+浓度相同的稀硫酸,发现反应会比原来慢许多,可能为阴离子的影响.
解答 解:(1)由v=$\frac{△V}{△t}$知,反应速率与气体的体积和时间有关,所以一种是固定体积比较时间,另一种是固定时间比较体积,
故答案为:相同时间内产生气体体积大小;
(2)影响化学反应速率的因素有反应物的浓度、溶液的温度、固体的表面积等,所以还需保证Al和Fe表面积相同,
故答案为:Al和Fe表面积相同;
(3)该反应是一个放热的反应,随着反应的进行,放出的热量越多,溶液的温度越高,温度越高反应速率越大;随着反应的进行,溶液中盐酸的浓度不断减小,浓度越小反应速率越小,
故答案为:放热;盐酸浓度不断减小;
(4)盐酸和稀硫酸具有相同的阳离子H+,稀盐酸改成H+浓度相同的稀硫酸,发现反应会比原来慢许多,可能为Cl-会促进该反应的进行,(或SO42-抑制该反应的进行),
故答案为:Cl-会促进该反应的进行,(或SO42-抑制该反应的进行).
点评 本题考查了化学反应速率的影响因素,外界条件影响化学反应速率,注意决定化学反应速率的是物质本身的性质,题目难度不大.

练习册系列答案
相关题目
9.某反应方程式为 ,下列说法错误的是( )
,下列说法错误的是( )
 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 反应物的分子式为C10H10O4 | |
| B. | X的结构简式为CH3OH | |
| C. | 生成物中带“※”号的C原子来自“ ”中的甲基 ”中的甲基 | |
| D. | 反应物和生成物具有相同的不饱和度 |
16.某同学对“NaOH和NH4Cl都是离子化合物”,有下列四点感悟,其中错误的是( )
| A. | 离子化合物中可能含共价键 | B. | 碱和铵盐都是离子化合物 | ||
| C. | 离子化合物中不一定含金属元素 | D. | 离子化合物中一定含离子键 |
13.下列事实能够证明Al2O3中一定存在离子键的是( )
| A. | 水溶液能导电 | B. | 有较高的熔点 | C. | 熔化时能导电 | D. | 易溶于水 |
10.下列微粒属于等电子体的是( )
| A. | 12CO2和14CO | B. | H2O和NH3 | C. | N2和13CO | D. | NO和CO |


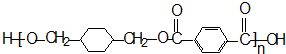
 -CH3+Cl2→
-CH3+Cl2→ -CH2Cl+HCl
-CH2Cl+HCl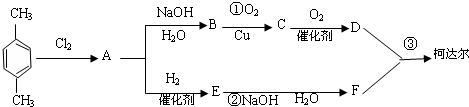
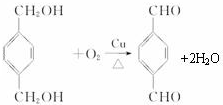
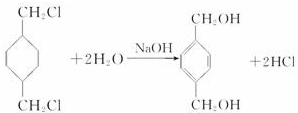
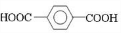 +
+ $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$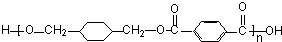 +(2n-1)H2O.
+(2n-1)H2O.