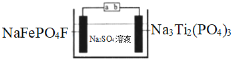
��Ŀ����
����Ŀ����.�����£���ijһԪ��HA(�ס��ҡ�������������ͬ��һԪ��)��NaOH��Һ�������ϣ�������Һ�����ʵ�����Ũ�Ⱥͻ��Һ��pH���±���ʾ��
ʵ���� | HA����������Ũ��(mol��L-1) | NaOH����������Ũ��(mol��L-1) | ��Ϻ���Һ��pH |
�� | 0.1 | 0.1 | pH��a |
�� | 0.12 | 0.1 | pH��7 |
�� | 0.2 | 0.1 | pH��7 |
�� | 0.1 | 0.1 | pH��10 |
��1�������������������������HA��ǿ�ỹ������ ��
��2�����������Һ������Ũ��c(A-)��c(Na+)�Ĵ�С��ϵ�� ��
A��ǰ�ߴ� B�����ߴ� C��������� D�����ж�
��3��������ʵ������������������Һ������Ũ���ɴ�С��˳���� ��
��4����������ʵ�����ݣ�д���������Һ��������ʽ�ľ�ȷ����(��ʽ)��c(Na+)��c(A-)�� mol/L��
��.ij��Ԫ��(����ʽ��H2B��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�H2B=H++HB-��HB-![]() H++B2-
H++B2-
�ش��������⣺
��5����0.1 mol/L��Na2B��Һ�У���������Ũ����ϵʽ��ȷ���� ��
A��c(B2-)+c(HB-)��0.1mol/L
B��c(B2-)+c(HB-)+c(H2B)��0.1mol/L
C��c(OH-)��c(H+)+c(HB-)
D��c(Na+)+c(OH-)��c(H+)+c(HB��)
���𰸡���1��a=7ʱ��HA��ǿ����a>7ʱ��HA������
��2��C(3������3��c(Na+)>c(A-)>c(OH-)>c(H+)(3����
��4��10-4-10-3(3������5��A��C(3����
��������
�����������1��һԪ��HA��NaOH�����ʵ�����Ӧ������ǿ��ȡ������ȫ�кͺ��ε�pH����a=7Ϊǿ������a��7Ϊ������
��2���ݵ���غ�����c(Na+)+c(H+)��c(A-)+c(OH-)����c(H+)��c(OH-)������c(Na+)��c(A-)����ѡC��
��3����Ϊ��Ũ�ȵ�HA��NaA�Ļ����Һ����pH��7֪A-ˮ��̶ȴ���HA�ĵĵ���������Ũ�ȴ�С��ϵΪc(Na+)��c(A-)��c(OH-)��c(H+)��
��4���ݵ���غ�c(Na+)+c(H+)��c(A-)+c(OH-)���Ƶ�c(Na+)-c(A-)��c(OH-)��c(H+)����10-4-10-10��mol/L��
��5����Na2B�д���ˮ��ƽ�⣺B2-+H2O![]() HB- +OH-��HB-�����һ��ˮ�⣬������Һ��û��H2B���ӡ�A�����������غ��c( B2- )+c(HB- )��0.1 mol/L��A��ȷ��B����Һ��û��H2B���ӣ����Ը��������غ�ɵã�c(Na+)��2[c(B2-)+ c(HB- )]��B����C�����������غ��c(OH- )=c(H+)+c(HB- )��C����D�����ݵ���غ���֪c(Na+)+c(H+)��c(OH-)+c(HB-)+2c(B2- )��D��������ѡAC��
HB- +OH-��HB-�����һ��ˮ�⣬������Һ��û��H2B���ӡ�A�����������غ��c( B2- )+c(HB- )��0.1 mol/L��A��ȷ��B����Һ��û��H2B���ӣ����Ը��������غ�ɵã�c(Na+)��2[c(B2-)+ c(HB- )]��B����C�����������غ��c(OH- )=c(H+)+c(HB- )��C����D�����ݵ���غ���֪c(Na+)+c(H+)��c(OH-)+c(HB-)+2c(B2- )��D��������ѡAC��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ʵ�����������ͽ��۾���ȷ���ǣ� ��
ѡ�� | ʵ����� | ���� | ���� |
A | ȡ1mL20%������Һ����������ϡ���ᣬˮԡ���Ⱥ�ȡ������Һ�����뼸�����Ƶ�Cu(OH)2����Һ������û��ש��ɫ�������� | ��Һ��δ����ש����� | ����δˮ�� |
B | ��C��SiO2�Ĺ���������ȼ��� | 2C+SiO2 | �ǽ����ԣ�C>Si |
C | ��ʢ��2mL0.1molL-1��NaCl��Һ���Թ�����μ��뼸��0.1molL-1AgNO3��Һ����ַ�Ӧ������μ���AgNO3��Һ����ַ�Ӧ������μ���0.1molL-1��KI��Һ | ��ɫ������Ϊ��ɫ���� | Ksp(AgCl)>Ksp(Agl)�� |
D | �����Һ�м���������ϡNaOH��Һ����ʪ�����ɫʯ����ֽ�����Թܿ� | ʪ�����ɫʯ����ֽδ��� | ����Һ�в�����NH4+ |
A.AB.BC.CD.D