题目内容
【题目】A、B、C、D四种元素原子的核电荷数依次增大![]() 均小于
均小于![]() ,其单质及相应的化合物能发生如下反应关系:
,其单质及相应的化合物能发生如下反应关系:
(1)写出F的电子式 ______ 。
(2)气体H有毒,可用![]() 溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
(3)加热E的水溶液后并灼烧,最终得到的固体为 ______ ,原因为 ______ 、 ______ ![]() 用化学反应方程式来表示
用化学反应方程式来表示![]() 。
。
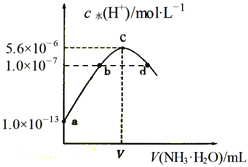
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的![]() ,则此溶液中离子浓度由小到大的顺序为: ______ 。
,则此溶液中离子浓度由小到大的顺序为: ______ 。
(5)将气体H放在空气中充分燃烧可得到气体氧化物![]() ,
,![]() 可与氧气继续反应:
可与氧气继续反应:![]() ,在一个固定容积为2L的密闭容器中充入
,在一个固定容积为2L的密闭容器中充入![]() 的
的![]() 和
和![]() 的
的![]() ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含![]() 为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入
为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入![]()
![]() 和
和![]()
![]() ,再次达到新平衡后,
,再次达到新平衡后,![]() 的物质的量介于 ______ 之间。
的物质的量介于 ______ 之间。
(6)写出E和F反应的化学反应方程式: ______ 。
【答案】![]()
![]()
![]()
![]() 2Al(OH)3
2Al(OH)3![]() Al2O3+3H2O c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Cl-)<c(K+)
Al2O3+3H2O c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Cl-)<c(K+) ![]()
![]() 和
和![]()
![]()
【解析】
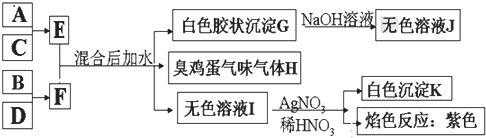
A、B、C、D四种元素原子的核电荷数均小于20,G是白色胶状沉淀,溶于氢氧化钠溶液,G为Al(OH)3,J为NaAlO2,H为臭鸡蛋气味的气体,H为H2S,无色溶液I与硝酸银、硝酸反应生成白色沉淀K,K为AgCl,进行焰色反应为紫色,故I为KCl;根据E+F![]() Al(OH)3↓+H2S↑+KCl,结合原子守恒,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S,据此分析。
Al(OH)3↓+H2S↑+KCl,结合原子守恒,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S,据此分析。
A、B、C、D四种元素原子的核电荷数均小于20,G是白色胶状沉淀,溶于氢氧化钠溶液,G为Al(OH)3,J为NaAlO2,H为臭鸡蛋气味的气体,H为H2S,无色溶液I与硝酸银、硝酸反应生成白色沉淀K,K为AgCl,进行焰色反应为紫色,故I为KCl;根据E+F![]() Al(OH)3↓+H2S↑+KCl,结合原子守恒,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S;
Al(OH)3↓+H2S↑+KCl,结合原子守恒,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S;
(1)F为K2S,属于离子化合物,由钾离子与硫离子构成,电子式为:![]() ;
;
(2)H2S有毒,可用Na2CO3溶液吸收,生成两种酸式盐,为NaHS、NaHCO3,反应方程式为:H2S+Na2CO3=NaHS+NaHCO3;
(3)E为AlCl3,AlCl3的水溶液中存在水解平衡AlCl3+3H2O Al(OH)3+3HCl,加热AlCl3的水溶液,由于HCl的挥发,促进水解得到Al(OH)3,灼烧Al(OH)3,Al(OH)3分解:2Al(OH)3![]() Al2O3+3H2O,最终得到的固体为Al2O3;
Al2O3+3H2O,最终得到的固体为Al2O3;
(4)室温下,向K2S的水溶液中加入等体积等浓度的盐酸,K2S与HCl物质的量相等,发生反应K2S+HCl=KHS+KCl,混合后溶液为等浓度的KHS、KCl溶液,溶液的pH>7,则c(H+)<c(OH-),说明HS-的水解程度大于电离程度,故c(HS-)<c(Cl-),水解程度很小,故c(OH-)<c(HS-),溶液中H+来自水的电离与HS-电离,所以c(S2-)<c(H+),溶液中K+浓度最大,故溶液中离子浓度由小到大的顺序为:c(S2-)<c(H+)<c(OH-)<c(HS-)<c(Cl-)<c(K+);
(5)在一个固定容积为2L的密闭容器中充入0.20mol的SO2和0.10mol的O2,半分钟后达到平衡,测得容器中含SO3为0.18mol,υ(SO3)= =0.18mol/(Lmin),速率之比等于化学计量数之比,故υ(O2 )=
=0.18mol/(Lmin),速率之比等于化学计量数之比,故υ(O2 )=![]() υ(SO3)=
υ(SO3)=![]() ×0.18mol/(Lmin)=0.09mol/(Lmin);
×0.18mol/(Lmin)=0.09mol/(Lmin);
若继续通入0.20mol SO2和0.10mol O2,压强增大,平衡向正反应移动,反应转化率增大,再次达到新平衡后,SO3的物质的量大于0.18mol×2=0.36mol,若0.4molSO2与0.2molO2完全反应,可以生成0.4molSO3,反应物不能完全转化,故SO3小于0.4mol,即SO3的物质的量介于0.36mol和0.40mol之间;
(6)E和F反应生成氢氧化铝、硫化氢和氯化钾,反应的化学反应方程式为:![]() 。
。

【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”。引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气。
I、用NH3催化还原NOx可以消除氮氧化物的污染。反应原理为:NO(g)+NO2(g)+2NH3(g) ![]() 2N2(g)+3H2O(g)。
2N2(g)+3H2O(g)。
(1)该反应的△S________0(填“>”、“=”或“<”)。
(2)II、已知反应N2O4(g) ![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
a.气体颜色不再改变b.△H不再改变
c.v正(N2O4)=2v逆(NO2)d.N2O4的转化率不再改变
(3)III、用CH4催化还原NOx也可以消除氮氧化物的污染。
已知:CH4(g)的标准燃烧热为-890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1114 kJ/mol
2NO(g)+O2(g)=2NO2(g)△H=﹣114 kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:________。
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
温度/℃ | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)=________。
②温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将________(填“增大”、“减小”或“不变”)。
【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ____________,ΔH__0(填“<”“ >”或“ =”)。
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时C的物质的量为_____;则反应达到平衡时,A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____(填“增大”“减少”或“不变”)。
(3)1200℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为_______。
A(g)+B(g)的平衡常数的值为_______。