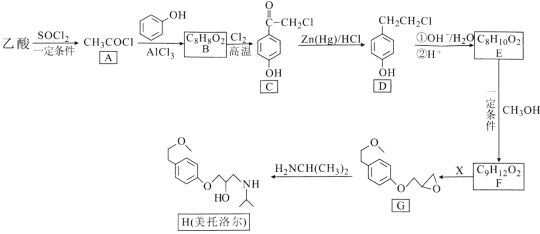
题目内容
【题目】Ⅰ.(1)将Mg条放入浓NH4Cl溶液中产生氢气,请用离子方程式解释该现象产生的原因__________。
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,可表示为(用离子方程式表示)_______,若向此浊液中加入浓的NH4Cl溶液,观察到的现象是________。
Ⅱ.盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5;H2CO3的电离常数Ka1=4.2×10-7、Ka2=5.6×10-11
(1)①用离子方程式解释碳酸氢钠水溶液显碱性的原因______________。
②常温下,物质的量浓度相同的下列四种溶液:
a.碳酸钠溶液 b.醋酸钠溶液 c.氢氧化钠溶液 d.氢氧化钡溶液,
其pH由大到小的顺序是_______________(填序号)。
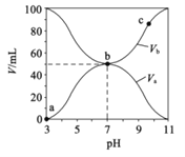
(2)某温度下,将pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应溶液中水的电离程度由大到小的顺序为_________。

(3)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,则在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液pH=______。
【答案】NH4++H2O![]() NH3·H2O+H+、Mg+2H+=Mg2++H2↑或合并写 Mg(OH)2(s)
NH3·H2O+H+、Mg+2H+=Mg2++H2↑或合并写 Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq) 沉淀溶解,溶液澄清 HCO3-+H2O
Mg2+(aq)+2OH-(aq) 沉淀溶解,溶液澄清 HCO3-+H2O![]() H2CO3+OH- d c a b b=c>a 11
H2CO3+OH- d c a b b=c>a 11
【解析】
Ⅰ.(1)NH4Cl水解,溶液呈酸性,镁条与氢离子反应放出氢气;
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,加入浓的NH4Cl溶液,铵根离子结合氢氧化镁电离出的氢氧根离子生成一水合氨,促进Mg(OH)2的沉淀溶解平衡正向移动。
Ⅱ. (1)①碳酸氢钠中碳酸氢根离子水解程度大于电离程度而导致其溶液呈碱性;
②氢氧根离子浓度越大,溶液的pH越大,水解程度大的阴离子对应的碱性越强,据此回答;
(2)酸抑制水电离,酸电离出的氢离子浓度越大,对水电离的抑制作用越强;
(3)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,Kw= c(H+)×c(OH-),则在该温度下Kw=10-12。
Ⅰ.(1)NH4Cl水解,溶液呈酸性,将Mg条放入浓NH4Cl溶液中,镁条与氢离子反应放出氢气,反应离子方程式是NH4++H2O![]() NH3·H2O+H+、Mg+2H+=Mg2++H2↑;
NH3·H2O+H+、Mg+2H+=Mg2++H2↑;
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),若向此浊液中加入浓的NH4Cl溶液,铵根离子结合氢氧化镁电离出的氢氧根离子生成一水合氨,促进Mg(OH)2的沉淀溶解平衡正向移动,Mg(OH)2固体溶解,所以观察到的现象是沉淀溶解,溶液澄清;
Mg2+(aq)+2OH-(aq),若向此浊液中加入浓的NH4Cl溶液,铵根离子结合氢氧化镁电离出的氢氧根离子生成一水合氨,促进Mg(OH)2的沉淀溶解平衡正向移动,Mg(OH)2固体溶解,所以观察到的现象是沉淀溶解,溶液澄清;
Ⅱ.(1)碳酸氢钠中碳酸氢根离子水解程度大于电离程度而导致其溶液呈碱性,碳酸氢根离子水解方程式为:HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
②物质的量浓度相同的四种溶液,c、d是强碱,氢氧化钡中氢氧根离子浓度大,所以pH大,ab中阴离子水解,导致溶液显示碱性,醋酸钠根离子的水解程度小于碳酸根离子,所以碳酸钠的碱性强于醋酸钠,即pH由大到小的顺序是:dcab;
(2)酸抑制水电离,酸电离出的氢离子浓度越大,对水电离的抑制作用越强,a点的pH最小,酸性最强,水电离程度最小,b、c点的pH相等,水电离程度相同,所以a、b、c三点对应溶液中水的电离程度由大到小的顺序为b=c>a;
(3)在t℃时,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合,氢氧化钠过量,c(OH-)=![]() 0.1 mol·L-1,在t℃时Kw=10-12,c(H+)=10-amol·L-11,pH=11。
0.1 mol·L-1,在t℃时Kw=10-12,c(H+)=10-amol·L-11,pH=11。

 口算能手系列答案
口算能手系列答案【题目】下列是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=9.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. H2CO3、HCO3-、CH3COO-、ClO- 在溶液中可以大量共存
B. 等体积等浓度的CH3COONa和NaClO中离子总数:CH3COONa <NaClO
C. 向浓度均为1.0×10-3 mol·L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol·L-1的AgNO3溶液,CrO42―先形成沉淀
D. 向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液的pH=5