题目内容
【题目】(1)某课外活动小组用如图装置进行实验,试回答下列问题:
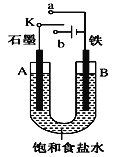
①若开始时开关K与a连接,则A极的电极反应式为____B极的Fe发生_____腐蚀(填“析氢”或“吸氧”)
②若开始时开关K与b连接,则装置内总反应的离子方程式为______;根据此时的装置,判断下列说法正确的是_____(填序号)
a. 溶液中Na+向A极移动
b. 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
c. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
d. 若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
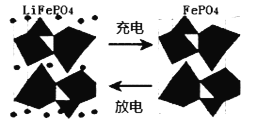
①已知该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的_____极(填“正”或“负”),该电极反应式为_____。
②用此电池电解含有0.1mol/LCuSO4和0.1mol/LNaCl的混合溶液100mL,假如电路中转移了0.02mole-,且电解池的电极均为惰性电极,则阳极产生的气体在标准状况下的体积是_____L。
【答案】O2+2H2O+4e-=4OH- 吸氧 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ b 正 FePO4+e-+Li+=LiFePO4 0.168L
2OH-+H2↑+Cl2↑ b 正 FePO4+e-+Li+=LiFePO4 0.168L
【解析】
(1)①若开始时开关K与a连接,构成原电池,铁是负极、石墨为正极;
②若开始时开关K与b连接,构成电解池,石墨作阳极;
(2)①根据图示,放电时FePO4得电子发生还原反应生成LiFePO4;
②根据离子的放电顺序,阳极电极反应依次为:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑;
(1)①若开始时开关K与a连接,构成原电池,铁是负极、石墨为正极,电解质为中性,属于Fe的吸氧腐蚀,正极是氧气得电子生成氢氧根离子,正极反应式是O2+2H2O+4e-=4OH-;
②若开始时开关K与b连接,构成电解池,石墨作阳极,阳极氯离子失电子生成氯气、阴极氢离子得电子生成氢气,则装置内总反应的离子方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;a. 原电池中阳离子移向阴极,所以溶液中Na+向B极移动,故a错误;
2OH-+H2↑+Cl2↑;a. 原电池中阳离子移向阴极,所以溶液中Na+向B极移动,故a错误;
b. A是阳极,生成氯气,所以从A极处逸出的气体能使湿润的KI淀粉试纸变蓝,故b正确;
c. 电解饱和食盐水放出氢气和氯气,所以反应一段时间后加适量氯化氢可恢复到电解前电解质的浓度,故c错误;
d.溶液中通过离子移动导电,溶液中没有电子移动,故d错误。
(2)①根据图示,放电时FePO4得电子发生还原反应生成LiFePO4,所以FePO4是负极,电极反应式为FePO4+e-+Li+=LiFePO4;
②0.1 mol/LCuSO4和0.1 mol/LNaCl的混合溶液100 mL含有0.01molCuSO4和0.01molNaCl,阳极电极反应依次为:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,当电路中转移了0.02 mole-时,生成氯气0.005mol,转移0.001mol电子,利用电子守恒生成氧气![]() 0.0025mol,所以阳极上生成的气体在标准状况下的体积=(0.005mol+0.0025mol)×22.4L/mol=0.168L。
0.0025mol,所以阳极上生成的气体在标准状况下的体积=(0.005mol+0.0025mol)×22.4L/mol=0.168L。

 名校课堂系列答案
名校课堂系列答案