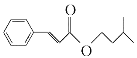
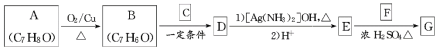
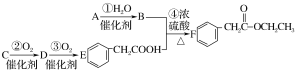
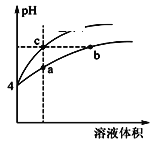
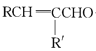题目内容
【题目】25℃时,将浓度均为0.1mol/L。体积分别为![]() 和
和![]() 的HA溶液与BOH溶液按不同体积比混合,保持
的HA溶液与BOH溶液按不同体积比混合,保持![]() +
+![]() =100mL,
=100mL,![]() 、
、![]() 与混合溶液的pH的关系如图所示。下列说法正确的是( )
与混合溶液的pH的关系如图所示。下列说法正确的是( )
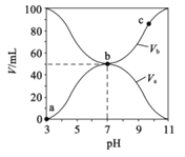
A.a→b过程中水的电离程度始终增大
B.![]() mol/L1
mol/L1
C.b点时,c(B-)=c(A-)=c(OH-)=c(H+)
D.由图可知BOH一定是强碱
【答案】A
【解析】
A. HA是弱酸,酸电离产生H+对水的电离平衡起抑制作用,在a→b过程中,酸被碱中和,溶液中酸电离产生的c(H+)减小,其对水的电离的抑制作用减弱,故水的电离程度始终增大,A项正确;
B. Ka(HA)=![]() mol/L,B项错误;
mol/L,B项错误;
C. b点是两者等体积混合溶液呈中性,c(B-)=c(A-),c(OH-)=c(H+),盐电离产生离子浓度远大于水电离产生的离子浓度,故离子浓度的大小为:c(B-)=c(A-)>c(OH-)=c(H+),C项错误;
D. 根据图知,酸溶液的pH=3,则c(H+)<0.1mol/L,说明HA是弱酸;碱溶液的pH=11,c(OH-)<0.1mol/L,则BOH是弱碱,D项错误;
答案选A。

【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
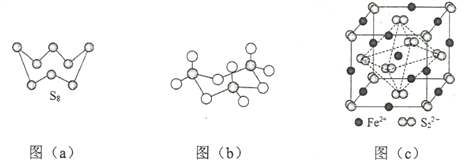
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥