题目内容
11. (1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:①该电池的负极材料是Cu,发生氧化反应(填“氧化”或“还原”),电解质溶液是AgNO3溶液;
②正极上出现的现象是碳棒上出现银白色物质;
③若导线上转移电子1mol,则生成银108克.
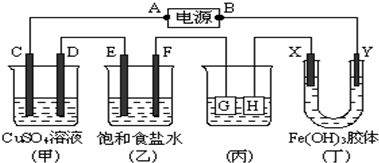
(2)电解原理在化学工业中有广泛应用.如图表示一个电解池,U型管中装有饱和CuCl2溶液,X、Y都是石墨电极,通过导线与直流电源相连.请回答以下问题:
①写出电解池中X极发生了还原反应(填氧化或还原).X极观察到的现象是碳棒上有红色物质附着.
②Y极发生的电极反应式是2Cl--2e-=Cl2↑,检验Y电极反应产物的方法是将湿润的淀粉碘化钾试纸放在U形管Y口,试纸变蓝色.
③若作为铜的电解精炼装置,Y极材料为粗铜,电解质溶液为硫酸铜溶液.
(3)钢铁腐蚀是自然界中的普遍现象.在海洋中航行的轮船,为防止腐蚀,可在轮船外侧焊接锌块.则其负极材料为金属锌,负极电极反应式为Zn-2e-=Zn2+,.
分析 (1)在Cu+2Ag+=2Ag+Cu2+反应中,Cu被氧化,应为原电池的负极,电解反应为:Cu-2e-=Cu2+,Ag+得电子被还原生成单质Ag,正极上有银白色物质生成,电极反应为Ag++e-=Ag,应为原电池正极反应,正极材料为活泼性比Cu的金属或非金属材料,电解质溶液为含Ag+离子的溶液,如AgNO3,原电池工作时,电子从负极经外电路流向正极,溶液中阳离子向正极移动,阴离子向负极移动,以形成闭合回路;
(2)Y与电源正极相连,为电解池的阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,X连接电源的负极,为电解池的阴极,发生还原反应,电极方程式为Cu2++2e-=Cu,如进行铜的精炼,则粗铜为阳极,纯铜为阴极,以此解答该题;
(3)负极材料是活泼的金属锌,发生氧化反应,电极反应式为Zn-2e-=Zn2+.
解答 解:(1)①在Cu+2Ag+=2Ag+Cu2+反应中,Cu被氧化,应为原电池的负极,电解反应为:Cu-2e-=Cu2+,电解质溶液为含Ag+离子的溶液,如AgNO3,
故答案为:Cu;氧化;AgNO3溶液;
②Ag+得电子被还原生成单质Ag,正极上有银白色物质生成,电极反应为Ag++e-=Ag,应为原电池正极反应,
故答案为:碳棒上出现银白色物质;
③正极反应为Ag++e-=Ag,若导线上转移电子1mol,则生成银1mol,质量为108g,故答案为:108;
(2)①X连接电源的负极,为电解池的阴极,发生还原反应,电极方程式为Cu2++2e-=Cu,可观察到碳棒上有红色物质附着,
故答案为:还原;碳棒上有红色物质附着;
②Y与电源正极相连,为电解池的阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,检验氯气,可将湿润的淀粉碘化钾试纸放在U形管Y口,试纸变蓝色,
故答案为:2Cl--2e-=Cl2↑;将湿润的淀粉碘化钾试纸放在U形管Y口,试纸变蓝色;
③如进行铜的精炼,则粗铜为阳极,纯铜为阴极,则Y极为粗铜,电解质溶液为硫酸铜溶液,故答案为:粗铜;硫酸铜溶液;
(3)负极材料是活泼的金属锌,发生氧化反应,电极反应式为Zn-2e-=Zn2+,故答案为:金属锌;Zn-2e-=Zn2+.
点评 本题考查原电池的设计,题目难度不大,注意两极材料的判断以及电极反应式的书写方法.

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
| A. | V(A)=0.6 mol/(L•s) | B. | V(B)=0.9 mol/(L•s) | C. | V(C)=0.4 mol/(L•s) | D. | V(D)=1.0 mol/(L•s) |
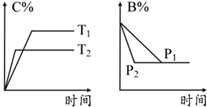
| A. | T1>T2 | B. | 正反应为放热反应 | ||
| C. | P1>P2 | D. | a+b=c+d |
 用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.
用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.
 .
. 表示的分子式为C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.
表示的分子式为C6H14结构简式(CH3)2CHCH2CH2CH3名称是2-甲基戊烷.