题目内容
16.可逆反应aA(s)+bB(g)?cC(g)+dD(g),反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是( )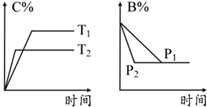
| A. | T1>T2 | B. | 正反应为放热反应 | ||
| C. | P1>P2 | D. | a+b=c+d |
分析 可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短,由图象可知T2>T1;
当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短,由图象可知p2>p1;
根据温度、压强对化学平衡移动的影响解答该题.
解答 解:当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短,由图象可知T2>T1,温度越高,平衡时C的百分含量(C%)越小,说明升高温度平衡逆移,故此反应的正反应为放热反应;
当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短,由图象可知p2>p1;
增大压强时B%不变,说明压强对平衡无影响,所以反应前后气体的计量数相等,即b=c+d,
根据以上分析可知,B正确,ACD错误;
故选:B.
点评 本题考查了物质的百分含量随温度、压强变化曲线的分析,难度不大,明确“先拐先平数值大”是解本题的关键.

练习册系列答案
相关题目
6.向含有1mol配合物[Co(NH3)5Cl]Cl2的溶液中加入足量的硝酸银溶液,得到的沉淀物质的量为( )
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 3mol |
7.以下是几种常见的制气装置,其中可用于制取乙炔的是( )
| A. |  | B. |  | C. |  | D. |  |
4.某物质结构简式如图所示,下列有关该物质的说法不正确的是( )


| A. | 该物质分子式为C13H16O4 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 在一定条件下可发生加成、取代、消去反应 | |
| D. | 1 mol该物质最多能与2mol NaOH反应 |
1.下列关于有机化合物的说法错误的是( )
| A. | 乙醇和乙酸都存在羟基 | |
| B. | 甲烷和甲苯都可以与氯气反应 | |
| C. | 高锰酸钾可以氧化甲苯和乙醛 | |
| D. | 乙烯可以发生加成反应,苯不能发生加成反应 |
8.下列反应原理中,不符合工业冶炼金属实际情况的是( )
| A. | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | 2A12O3 $\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑ | ||
| C. | H2+Na2O $\frac{\underline{\;高温\;}}{\;}$2Na+H2O | D. | 4 CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 |
5.把含硫酸铵和硝酸铵的混合液2a L分成两等份.一份加入bmol NaOH并加热,恰好把NH3全部赶出;另一份需消耗cmol BaCl2沉淀反应恰好完全,则原溶液中NO3-的浓度为( )
| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-4c}{a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{b-4c}{a}$ |
 (1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题: