题目内容
1.如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: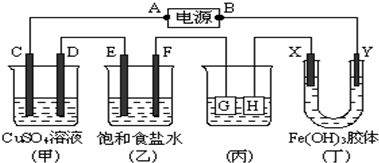
(1)电源A极的名称是正极.
(2)装置甲中C电极的电极反应式为4OH--4e-=O2↑+2H2O.
(3)欲用丙装置给铜镀银,G应该是银(填“铜”或“银”)电极,电镀液的主要成分是AgNO3(填化学式).若外电路中通过0.1mol电子时,H电极的质量改变是10.8g.
(4)装置丁中的现象是X极附近颜色变浅,Y极附近颜色加深,说明说明Fe(OH)3胶体中的胶粒带正电荷.
分析 (1)电解饱和食盐水时,酚酞变红的极是阴极,阴极和电源负极相连;
(2)根据电解原理来书写电池反应;
(3)欲用丙装置给铜镀银,G为阳极应该是银,电镀液的主要成分是AgNO3溶液,根据Ag++e-=Ag计算;
(4)根据异性电荷相吸的原理以及胶体的电泳原理来回答.
解答 解:(1)向乙中滴入酚酞试液,在F极附近显红色,说明该极上氢离子放电,所以该电极是阴极,所以E电极是阳极,D电极是阴极,C电极是阳极,G电极是阳极,H电极是阴极,X电极是阳极,Y是阴极,A是电源的正极,B是原电池的负极,故答案为:正极;
(2)电解硫酸铜溶液时的阳极是氢氧根离子放电,反应式为4OH--4e-=O2↑+2H2O,阴极是铜离子,放电反应式为Cu2++2e-=Cu,故答案为:4OH--4e-=O2↑+2H2O;
(3)欲用丙装置给铜镀银,G为阳极应该是银,电镀液的主要成分是AgNO3溶液,根据Ag++e-=Ag,外电路中通过0.1mol电子时,生成0.1mol的银,质量为:10.8
g,故答案为:银;AgNO3;10.8;
(4)根据异性电荷相吸的原理,氢氧化铁胶体中含有的带正电荷的粒子会向阴极即Y极移动,所以Y极附近红褐色变深,故答案为:X极附近颜色变浅,Y极附近颜色加深;说明Fe(OH)3胶体中的胶粒带正电荷.
点评 本题是一道电化学综合知识题目,可以根据所学知识进行回答,难度较大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
12. 某同学在实验室进行实验研究化学反应速率的影响因素.
某同学在实验室进行实验研究化学反应速率的影响因素.
Ⅰ.下表是研究性学习小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(单位:s)
请你分析回答:
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)该研究小组在设计方案时,考虑了浓度、温度、催化剂等反应条件对过氧化氢分解速率的影响.
(3)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?温度升高化学反应速率加快(或反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快).
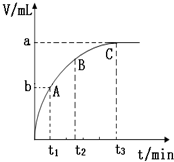
(4)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是C.
(5)若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,反应的离子方程式为MnO2+2H++H2O2=Mn2++O2↑+2H2O.
Ⅱ.现提供下列实验用品研究化学反应速率的影响因素.
实验仪器:试管、烧杯、量筒、天平、秒表
实验药品:铝片、铝粉、0.5mol/L 盐酸、5mol/L 盐酸
①利用所提供实验用品,可研究的化学反应速率的影响因素是盐酸的浓度、铝的表面积,
为了便于观察,你建议记录的数据是反应开始到停止所用的时间.
②若要研究温度对化学反应速率的影响,还需用到的主要仪器是温度计.
 某同学在实验室进行实验研究化学反应速率的影响因素.
某同学在实验室进行实验研究化学反应速率的影响因素.Ⅰ.下表是研究性学习小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(单位:s)
浓 度 反应条件 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加 热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)该研究小组在设计方案时,考虑了浓度、温度、催化剂等反应条件对过氧化氢分解速率的影响.
(3)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?温度升高化学反应速率加快(或反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快).
(4)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是C.
(5)若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,反应的离子方程式为MnO2+2H++H2O2=Mn2++O2↑+2H2O.
Ⅱ.现提供下列实验用品研究化学反应速率的影响因素.
实验仪器:试管、烧杯、量筒、天平、秒表
实验药品:铝片、铝粉、0.5mol/L 盐酸、5mol/L 盐酸
①利用所提供实验用品,可研究的化学反应速率的影响因素是盐酸的浓度、铝的表面积,
为了便于观察,你建议记录的数据是反应开始到停止所用的时间.
②若要研究温度对化学反应速率的影响,还需用到的主要仪器是温度计.
9.下列判断错误的是( )
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:MgO>NaCl>KCl | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
16.关于元素周期表中的16号元素的说法正确的是( )
| A. | 最高正价是+5价 | B. | 最低负价为-2价 | ||
| C. | 该元素位于第二周期 | D. | 该元素属于ⅤA族元素 |
13.下列各式能真实表示物质分子组成的是( )
| A. | SO2 | B. | CaCl2 | C. | SiO2 | D. | Na2O2 |
16.国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列.如碱金属为第1列,稀有气体元素为第18列.按此规定,下列说法中错误的是( )
| A. | 第9列元素中没有非金属元素 | |
| B. | 第17列为卤族元素 | |
| C. | 只有第2列元素原子的最外层有2个电子 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
17.X、Y、Z、M、W为五种短周期元素.X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示.下列说法不正确的是( )
| Y | Z | M | |
| W |
| A. | 原子半径:W>Y>Z>M>X | |
| B. | 热稳定性:XM>X2Z,沸点:X2Z>YX3 | |
| C. | X、Y、Z三种元素形成的化合物中不可能含离子键 | |
| D. | ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构 |
 (1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题:
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池(正极材料用碳棒),回答下列问题: