题目内容
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol/L的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol/L)为( )
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
| A.0.008889 | B.0.08000 | C.0.1200 | D.0.2400 |
B
解析试题分析:假设KMnO4溶液的物质的量浓度为C,体积为V则n(KMnO4)="C·V." KHC2O4·H2C2O4·2H2O与NaOH反应的化学方程式为:KHC2O4·H2C2O4·2H2O+3NaOH=KNaC2O4+Na2C2O4+2H2O.则根据这两个反应方程式可得关系式为:30NaOH ------10[KHC2O4·H2C2O4]------8KMnO4.即30mol的NaOH对应8mol的KMnO4。(3V×0.1000mol/L):(C·V)=30:8。解得C=0.08000mol/L所以选项为:B。
考点:考查滴定法在测定物质组成及浓度计算中的应用的知识。

 阅读快车系列答案
阅读快车系列答案0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为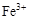 和
和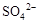 ,同
,同
时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
| A.30 | B.46 | C.50 | D.66 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法正确的是( )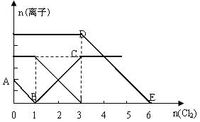
| A.还原性I->Fe2->Br- |
| B.原混合溶液中c(FeBr2) = 4mol/L |
| C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为:2Fe2+ + 2I- + 2Cl2 → 2Fe3+ + I2 + 4 Cl- |
| D.原溶液中n(Fe2+) :n(I-) :n(Br-) =" 2" :1 :3 |
在下列变化中,按氮元素被还原、被氧化、既被氧化又被还原、既不被氧化又不被还原的顺序排列正确的是 ①大气通过闪电固氮 ②硝酸分解 ③实验室用氯化铵和消石制取氨气 ④二氧化氮溶于水中
| A.①②③④ | B.②④①③ | C.①③④② | D.②①④③ |
下列变化需要加入适当的氧化剂才能实现的是
A.CuO Cu Cu | B.Fe2+ Fe Fe | C.H2SO4 SO2 SO2 | D.HCl Cl2 Cl2 |
将35.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况下)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44L NO(标准状况下),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
| A.66.4 g | B.50.8 g | C.44.8g | D.39.2g |
吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是
| A.作还原剂 | B.作氧化剂 |
| C.既作氧化剂又作还原剂 | D.既不作氧化剂又不作还原剂 |
下列变化需要加入还原剂才能实现的
A.MnO4-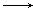 Mn2+ Mn2+ | B.HCl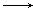 Cl2 Cl2 | C.Fe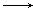 Fe3+ Fe3+ | D.KClO3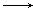 O2 O2 |