题目内容
5.下列坐标图均涉及到平衡原理,其中相关( )| A. | 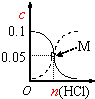 如图表示室温下,用0.1mol•L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3•H2O),虚线表示c(NH${\;}_{4}^{+}$),处于M点时溶液呈中性 | |
| B. | 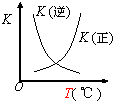 如图表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. | 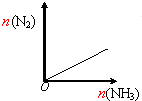 如图表示反应2NH3(g)?3H2(g)+N2(g),在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系 | |
| D. | 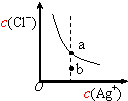 如图表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处 |
分析 A.处于M点时溶液中氨水和铵根离子浓度均为0.05mol/L;
B.升高温度平衡逆移,K(正)减小;
C.增大氮气的物质的量平衡逆移;
D.蒸发部分的水后,银离子和氯离子浓度均增大.
解答 解:A.处于M点时溶液中氨水和铵根离子浓度均为0.05mol/L,一水合氨的电离程度大于铵根离子的水解程度,溶液显碱性,故A错误;
B.已知该反应正方向为放热反应,升高温度平衡逆移,K(正)减小,K(增大),图象与实际不符,故B错误;
C.增大氮气的物质的量平衡逆移,氨气的物质的量增大,图象与实际相符合,故C正确;
D.蒸发部分的水后,银离子和氯离子浓度均增大,而b点到a点银离子浓度不变,故D错误.
故选C.
点评 本题考查了盐的水解和弱电解质的电离、平衡移动、难容电解质的溶解平衡等,把握图象中的信息是解题的关键,题目难度中等.

练习册系列答案
相关题目
15.化学与生活密切相关,下列说法正确的是( )
| A. | 绿色食品是只指纯天然食品,不含任何化学物质 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI | |
| D. | 只要带专用口罩,就不怕雾霾天气对人体产生伤害 |
17.设nA表示阿伏加德罗常数的数值,下列有关说法正确的是( )
| A. | 1 mol Cu和足量的硫反应,转移的电子数为nA | |
| B. | 标准状况下,22.4 L氯仿中含有的分子数为nA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1nA | |
| D. | 53.5g NH4Cl中含有的分子数为NA |
14.为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》.下列做法有利于该目标实现的是( )
| A. | 推广使用含磷洗涤剂 | B. | 用O3替代Cl2作饮用水消毒剂 | ||
| C. | 用工业污水直接灌溉农田 | D. | 含H2SO4的废水用BaCl2处理后排放 |
15.三种常见的酸(或碱)在水溶液中的电离情况如下表,下列说法正确的是
( )
| 温度/℃ | 化合物 | C/mol.L-1 | c(H+)/mol.L-1 | c(OH-)/mol.L-1 |
| 25 | HA | 1.0×10-2 | 1.0×10-2 | 1.0×10-12 |
| 25 | HB | 1.0×10-2 | 1.0×10-4 | 1.0×10-10 |
| 25 | MOH | 1.0×10-3 | 1.0×10-11 | 1.0×10-3 |
| 100 | MOH | 1.0×10-3 | 1.0×10-8 | 1.0×10-3 |
| A. | 温度相同,物质的量浓度也相同的MA和MB溶液,前者pH大于后者 | |
| B. | pH相同的HA和HB的溶液中c(A-)=c(B-) | |
| C. | 相同浓度的MOH溶液,溶液的碱性随温度的升高而减弱 | |
| D. | 25℃时MOH抑制水的电离,100℃时MOH促进水的电离 |
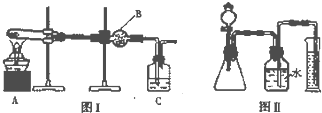 某研究性小组将一定浓度的NaCO3溶液滴入MgSO4溶液中得到白色沉淀,对于白色沉淀的成分进行研究:
某研究性小组将一定浓度的NaCO3溶液滴入MgSO4溶液中得到白色沉淀,对于白色沉淀的成分进行研究: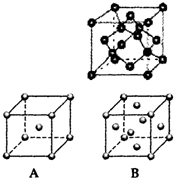 现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题: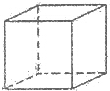 己知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小的主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+l价阳离子的K、L、M能层为全充满结构.
己知A、B、C、D、E、F、G、H八种元素都是周期表中前四周期的元素,它们的核电荷数依次增大,A是原子半径最小的主族元素,B有三种不同的能级且每种能级上所含电子数相同,C的单质性质稳定且一种氢化物极易溶于水,D能形成两种互为同素异形体的气态单质,A、D、E的核内质子数之和与F的核内质子数相同,F的基态原子中有4个未成对电子,G比F原子多一个核内质子,上述H元素的+l价阳离子的K、L、M能层为全充满结构.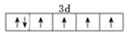 .在这两种离子之间Fe3+更稳定(填化学式):从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.
.在这两种离子之间Fe3+更稳定(填化学式):从微观结构角度解释该离子更稳定的原因:Fe3+离子的3d轨道为半满稳定状态.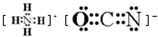
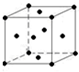 .该晶体中H原子直径为apm,H的相对原子质量为M,阿伏伽德罗常数为NA,求该晶胞密度表达式$\frac{\sqrt{2}M×1{0}^{30}}{{N}_{A}{a}^{3}}$g/cm3(用a,M,NA表示)
.该晶体中H原子直径为apm,H的相对原子质量为M,阿伏伽德罗常数为NA,求该晶胞密度表达式$\frac{\sqrt{2}M×1{0}^{30}}{{N}_{A}{a}^{3}}$g/cm3(用a,M,NA表示)