题目内容
20. 现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题:(1)羟胺(CA2DA)中采用sp3杂化的原子是N、O(填元素符号);羟胺极易溶于水,主要原因是羟胺与水分子之间可以形成氢键;
(2)F元素的=2价氧化物的熔点比+3价氧化物低(高或低),原因是Fe2+离子半径比Fe3+离子半径大,所带电荷少,FeO晶格能比Fe2O3小;
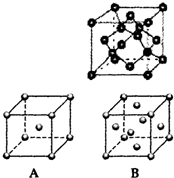
(3)B单质的一种同素异形体的晶胞如图所示,若晶体的密度为pg/cm3,阿伏伽德罗常数的值为NA,则晶体中最近的两个原子之间的距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$cm;
(4)①G原子的外围单质排布式为3d104s1;
②单质E、G的晶体的晶胞结构如图(请先判断对应的图),E、G两种晶体晶胞中元素原子的配位数之比为2:3.
(5)黄血盐(E4[F(BC)6)易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg.黄血盐经长时间火炒,超过400时会分解生成剧毒的EBC.
回答下列问题:
①E4[F(BC)6)中F2+与BC-两种离子之间的作用力是配位键;
②1mol BC-中含有π键的数目为2NA;
③黄血盐溶液与稀硫酸加热是发生非氧化还原反应,生成磷酸盐和一种与BC-是等电子体的气态化合物,该气态化合物为CO.
分析 A、B、C、D、E、F、G原子序数依次增大的7种元素,它们位于元素周期表的前四周期;B元素含有3个能级,且每个能级所含的电子数相同,原子核外电子排布为1s22s22p2,则B为C元素;D的原子核外有8个运动状态不同的电子,则D为O元素;C原子序数介于碳、氧之间,则C为N元素;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,应处于Ⅷ族及相邻的族,F元素的基态原子有4个未成对电子,应处于Ⅷ族及相邻的族,F元素的基态原子有4个未成对电子,外围电子排布为3d64s2,则F为Fe,故G为Cu;在这七种元素中E元素原子半径最大,A原子半径最小,则A为H元素,结合(5)①可知E的化合价为+1,故E为K元素,据此进行解答.
解答 解:A、B、C、D、E、F、G原子序数依次增大的7种元素,它们位于元素周期表的前四周期;B元素含有3个能级,且每个能级所含的电子数相同,原子核外电子排布为1s22s22p2,则B为C元素;D的原子核外有8个运动状态不同的电子,则D为O元素;C原子序数介于碳、氧之间,则C为N元素;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,应处于Ⅷ族及相邻的族,F元素的基态原子有4个未成对电子,应处于Ⅷ族及相邻的族,F元素的基态原子有4个未成对电子,外围电子排布为3d64s2,则F为Fe,故G为Cu;在这七种元素中E元素原子半径最大,A原子半径最小,则A为H元素,结合(5)①可知E的化合价为+1,故E为K元素,
(1)羟胺分子中,价层电子对为4的原子有N、O原子,所以采用sp3杂化的原子有N、O原子,由于羟胺与水分子之间可以形成氢键,所以羟胺极易溶于水,
故答案为:N、O;羟胺与水分子之间可以形成氢键;
(2)F为Fe元素,Fe2+离子半径比Fe3+离子半径大,所带电荷少,故FeO晶格能比Fe2O3小,FeO的熔点比Fe2O3低,
故答案为:低;Fe2+离子半径比Fe3+离子半径大,所带电荷少,FeO晶格能比Fe2O3小;
(3)B为C元素,晶胞中C原子数目=4+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,晶胞质量=8×$\frac{12}{{N}_{A}}$g=$\frac{96}{{N}_{A}}$g,若晶体的密度为ρg/cm3,则
晶胞体积=$\frac{\frac{96g}{{N}_{A}}}{ρg/c{m}^{3}}$=$\frac{96}{ρ{N}_{A}}$cm3,则晶胞棱长=$\root{3}{\frac{96}{ρ{N}_{A}}}$cm,C原子与周围4个C原子形成正四面体,该正四面体的棱长a=$\root{3}{\frac{96}{ρ{N}_{A}}}$cm×$\frac{\sqrt{2}}{2}$,斜面高为=$\frac{\sqrt{3}}{2}$a cm,底面中心到边的距离为$\frac{\sqrt{3}}{2}$a×$\frac{1}{3}$ cm,设中心碳原子到顶点碳原子距离为x cm,则中心碳原子到底面面心距离为$\frac{x}{3}$cm,故正四面体的高为(x+$\frac{x}{3}$)cm,则:(x+$\frac{x}{3}$)2+($\frac{\sqrt{3}}{2}$a×$\frac{1}{3}$ )2=($\frac{\sqrt{3}}{2}$a)2,整理得x=$\frac{\sqrt{6}}{4}$a,
即:x=$\frac{\sqrt{6}}{4}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$cm×$\frac{\sqrt{2}}{2}$=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{96}{ρ{N}_{A}}}$;
(4)①Cu是29号元素,其核外电子排布式为:1s22s22p43s23p63d104s1,则其外围电子排布式为:3d104s1,
故答案为:3d104s1;
②单质E、G分别为K、Cu,金属K晶体为体心立方堆积,晶胞结构为图A,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图B,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12,则K、Cu两种晶体晶胞中金属原子的配位数之比为 8:12=2:3,
故答案为:2:3;
(5)①K4[Fe(CN)6]中,亚铁离子含有空轨道,N原子含有孤电子对,所以F2+与BC-两种离子之间的作用力为配位键,
故答案为:配位键;
②CN-中碳原子含有2个σ键且不含孤电子对,所以碳原子的杂化方式为sp,1个CN-中含有2个π键,所以1molCN-中含有π键的数目为2NA个,
故答案为:2NA;
③黄血盐溶液与稀硫酸加热时发生非氧化还原反应,说明元素化合价不变,生成硫酸盐和一种与CN-是等电子体的气态化合物,根据元素守恒知该气态化合物是CO,
故答案为:CO.
点评 本题考查位置、结构与性质关系的综合应用,题目难度较大,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,推断各元素为解答关键,(3)晶胞的计算为难点,注意掌握分析、计算方法.

 光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )
光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )| A. | 从第10min到第12min时,生成Cl2的速率v(Cl2)=0.01mol•L-1•min-1 | |
| B. | 第8min时与第18min时反应的平衡常数相同 | |
| C. | 由于10min时条件的改变,使COCl2的转化率降低 | |
| D. | 在第14min时,改变的条件可能是压缩反应容器的体积 |
| A. | 磨豆成浆 | B. | 剪纸成花 | C. | 酿谷成酒 | D. | 雕石成像 |
 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )| A. | 该电池在常温下不能正常工作 | |
| B. | 熔融NaAlCl4不参与正常电极反应 | |
| C. | 正常充电的阴极反应;NaCl+e-=Na+Cl- | |
| D. | 过放电时正极反应:AlCl${\;}_{4}^{-}$-3e-=4Cl-+Al |
| A. |  如图表示室温下,用0.1mol•L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3•H2O),虚线表示c(NH${\;}_{4}^{+}$),处于M点时溶液呈中性 | |
| B. |  如图表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. |  如图表示反应2NH3(g)?3H2(g)+N2(g),在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系 | |
| D. |  如图表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处 |
| A. | 常温常压下,1mol氦气含有4nA个质子 | |
| B. | 1molNa2O2与足量CO2充分反应转移了2nA个电子 | |
| C. | 含49gH2SO4的硫酸溶液中含有nA个氢原子 | |
| D. | 标准状况下,22.4LHCHO含有nA个分子 |
| A. | 标准状况下,2.24 LH2O中含有的原子总数为3NA | |
| B. | 等物质的量的Na2O和Na2O2中含有的阴离子总数不同 | |
| C. | Imol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA | |
| D. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×l0-3NA |




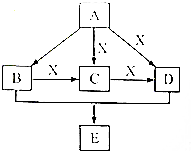 A、B、C、D、E均为常见的有机物,X是一种无机物,常温下A是气体,生活中的两种常见调味品中分别含有B和D,E是一种常见的有机溶剂和化工原料.《必修2》中介绍从A合成E的几种可能的合成路线,其转化关系可以用如图表示(图中部分产物及条件已略去).回答下列问题:
A、B、C、D、E均为常见的有机物,X是一种无机物,常温下A是气体,生活中的两种常见调味品中分别含有B和D,E是一种常见的有机溶剂和化工原料.《必修2》中介绍从A合成E的几种可能的合成路线,其转化关系可以用如图表示(图中部分产物及条件已略去).回答下列问题: ,工业上大量获得A的方法是石油裂解.
,工业上大量获得A的方法是石油裂解. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;