题目内容
15.三种常见的酸(或碱)在水溶液中的电离情况如下表,下列说法正确的是| 温度/℃ | 化合物 | C/mol.L-1 | c(H+)/mol.L-1 | c(OH-)/mol.L-1 |
| 25 | HA | 1.0×10-2 | 1.0×10-2 | 1.0×10-12 |
| 25 | HB | 1.0×10-2 | 1.0×10-4 | 1.0×10-10 |
| 25 | MOH | 1.0×10-3 | 1.0×10-11 | 1.0×10-3 |
| 100 | MOH | 1.0×10-3 | 1.0×10-8 | 1.0×10-3 |
| A. | 温度相同,物质的量浓度也相同的MA和MB溶液,前者pH大于后者 | |
| B. | pH相同的HA和HB的溶液中c(A-)=c(B-) | |
| C. | 相同浓度的MOH溶液,溶液的碱性随温度的升高而减弱 | |
| D. | 25℃时MOH抑制水的电离,100℃时MOH促进水的电离 |
分析 1.0×10-2mol/L的HA溶液中氢离子浓度为1.0×10-2mol/L,说明HA为强酸,1.0×10-2mol/L的HB溶液中氢离子浓度为1.0×10-4mol/L,说明HB为弱酸,1.0×10-3mol/L的MOH溶液中氢氧根离子浓度为1.0×10-3mol/L,说明MOH为强碱,100℃时,Kw=1.0×10-11,但升温氢氧根离子浓度不变,据此分析.
解答 解:A、HA为强酸,HB为弱酸,MA不水解,MB溶液水解溶液显碱性,所以温度相同,物质的量浓度也相同的MA和MB溶液,前者pH小于后者,故A错误;
B、据电荷守恒可知,pH相同的HA和HB溶液中,c(A-)=c(B-),故B正确;
C、MOH为强碱,相同浓度的MOH溶液,升温促进水的电离,水的离子积常数增大,氢离子浓度增大,但MOH电离出来的氢氧根离子浓度不变,故C错误;
D、强碱MOH始终抑制水的电离,故D错误;
故选B.
点评 本题考查了强弱电解质的区别和盐类水解、溶液中的电荷守恒、温度对电解质电离的影响,注意强电解质的电离与温度无关,题目难度不大.

练习册系列答案
相关题目
5.下列坐标图均涉及到平衡原理,其中相关( )
| A. |  如图表示室温下,用0.1mol•L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3•H2O),虚线表示c(NH${\;}_{4}^{+}$),处于M点时溶液呈中性 | |
| B. |  如图表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. |  如图表示反应2NH3(g)?3H2(g)+N2(g),在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系 | |
| D. |  如图表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处 |
6.下列装置或操作能达到实验目的是( )
| A. | 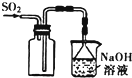 用图所示装置收集SO2气体 | |
| B. | 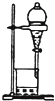 用图所示装置萃取碘水中的碘 | |
| C. | 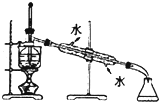 用图所示装置进行石油的分馏 | |
| D. | 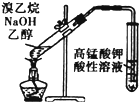 用图所示装置检验溴乙烷与NaOH乙醇溶液共热产生的乙烯 |
3.某二元酸H2A在水溶液中以下列方式进行电离:H2A═H++HA-、HA-?H++A2-下列说法正确的是( )
| A. | 室温时,NaHA溶液pH<7,是由于HA-的电离程度大于其水解程度 | |
| B. | 在0.1 mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1 mol/L | |
| C. | 在0.1 mol/L的NaHA溶液中,一定有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 向两份等体积NaHA、Na2A的浓度比为1:1的混合溶液中分别加入适当浓度的盐酸与氢氧化钠,其pH随加入酸、碱量的变化图象为: |
10.用眠表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 标准状况下,2.24 LH2O中含有的原子总数为3NA | |
| B. | 等物质的量的Na2O和Na2O2中含有的阴离子总数不同 | |
| C. | Imol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA | |
| D. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×l0-3NA |
20.下列有关化学用语表示正确的是( )
| A. | BeCl2分子的电子式: | |
| B. | 质子数为116,中子数为177的鉝(Lv)原子:${\;}_{116}^{293}$Lv | |
| C. | 氯离子的结构示意图: | |
| D. | 苯甲醇的结构简式: |
4.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是( )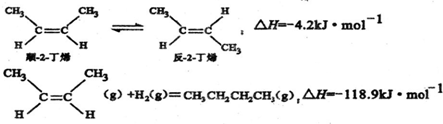

| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: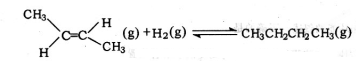 △H=-123.1kJ•mol-1 △H=-123.1kJ•mol-1 |
5.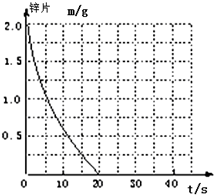 兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.
兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.
(1)酸液都取足量、相同体积,请你帮助完成以下面实验设计表(表中不要留空格):
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如上图.假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.
(3)某实验小组在做(1)中实验④时误加少量0.10mol/L CuCl2溶液,发现反应速率与(1)中实验①接近.该组同学对影响因素提出如下假设,请完成假设三:
假设一:Cu2+对该反应起催化剂作用
假设二:Cl-对该反应起催化剂作用
假设三:形成Zn-Cu原电池,加快反应速率(其它答案合理亦可)
…
(4)请你设计实验验证上述假设三是否成立,写出实验步骤及预期现象:
 兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.
兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.(1)酸液都取足量、相同体积,请你帮助完成以下面实验设计表(表中不要留空格):
| 实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
| ① | 298 | 0.20mol/L | / | a.实验①和②是探究不同温度对锌与盐酸反应速率的影响; b.实验①和③是探究不同浓度对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与锌反应速率的区别. |
| ② | 308 | 0.20mol/L | / | |
| ③ | 298 | 0.40mol/L | / | |
| ④ | 298 | / | 0.20 |
(3)某实验小组在做(1)中实验④时误加少量0.10mol/L CuCl2溶液,发现反应速率与(1)中实验①接近.该组同学对影响因素提出如下假设,请完成假设三:
假设一:Cu2+对该反应起催化剂作用
假设二:Cl-对该反应起催化剂作用
假设三:形成Zn-Cu原电池,加快反应速率(其它答案合理亦可)
…
(4)请你设计实验验证上述假设三是否成立,写出实验步骤及预期现象:
| 实验步骤 | 预期现象 |
| ①将不连接的铜、锌电极插入稀硫酸中,②将铜、锌电极用导线连接放入稀硫酸中 | 产生氢气的速率②大于①,证明构成原电池后可以大大加快反应速率 |
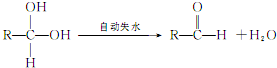
 ;
; ;
; ;
;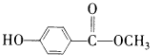 ,
,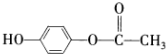 ?
?