题目内容
13. 某研究性小组将一定浓度的NaCO3溶液滴入MgSO4溶液中得到白色沉淀,对于白色沉淀的成分进行研究:
某研究性小组将一定浓度的NaCO3溶液滴入MgSO4溶液中得到白色沉淀,对于白色沉淀的成分进行研究:I.提出假设:[查阅资料知:MgCO3和Mg(OH)2均不带结晶水]
假设一:两者反应只生成MgCO3一种沉淀;
假设二:这两者相互促进水解,只生成Mg(OH)2一种沉淀;
假设三:生成MgCO3和Mg(OH)2两种沉淀.
II.理论探究:
按照假设二,Na2CO3溶液和MgSO4溶液反应的离子反应方程式为CO32-+Mg2++H2O═Mg(OH)2↓+CO2↑.
III.实验探究
步骤一:将一定浓度的Na2CO3溶液滴入MgSO4溶液中并充分搅拌,有白色沉淀生成.
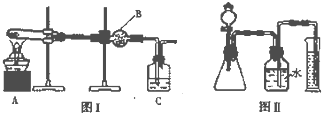
步骤二:将上述产生的白色沉淀从溶液中分离并净化,然后放入试管中加热,定性探究生成物的成分(如图I)
(1)图I中装置B的名称为干燥管,C装置中试剂是澄清石灰水.
(2)若假设二成立,则实验现象是B中无水硫酸铜变蓝色,C中澄清石灰水不变浑浊.
步骤三:某同学通过图II装置进行定量分析测定假设三的成分
(3)广口瓶中水面上覆盖了一层植物油,这层植物油的作用是防止生成的二氧化碳溶于水减小误差.
(4)若按上述操作,实验中测得样品的质量为wg,气体的体积为aL(标况下),则样品中MgCO3的质量分数为$\frac{\frac{a}{22.4}mol×84g/mol}{w}$×100%(不必化简).
分析 Ⅰ、依据假设一,假设二推断,一定浓度的NaCO3溶液滴入MgSO4溶液混合发生复分解反应生成碳酸镁沉淀,或发生双水解反应生成氢氧化镁沉淀,或二者都有;
Ⅱ、这两者相互促进水解反应,生成Mg(OH)2一种沉淀,则硫酸镁和碳酸镁相互促进水解生成氢氧化镁沉淀、硫酸钠和二氧化碳;
Ⅲ、(1)图1中装置B为干燥管,装置C中是用来验证二氧化碳气体的试剂澄清石灰水;
(2)若假设二成立,氢氧化镁试管中加热反应生成氧化镁和水,图Ⅰ中装置B盛有无水硫酸铜,检验水的存在,装置C是证明分解产物中是否生成二氧化碳气体,依据BC中现象判断沉淀成分;
(3)图II装置进行定量分析,利用排水法测定生成气体的体积,二氧化碳溶于水,为减少测定误差,广口瓶中水面上覆盖了一层植物油;
(4)假设Ⅲ沉淀为氢氧化镁和碳酸镁的混合物,加入酸反应生成气体为二氧化碳,排水法测定二氧化碳体积为aL,结合原子守恒计算碳酸镁质量得到质量分数.
解答 解:Ⅰ、依据假设一:两者反应只生成MgCO3一种沉淀,假设二:这两者相互促进水解,只生成Mg(OH)2一种沉淀,一定浓度的NaCO3溶液滴入MgSO4溶液混合发生复分解反应生成碳酸镁沉淀,或发生双水解反应生成氢氧化镁沉淀,或二者都有,所以假设三为:生成MgCO3和Mg(OH)2两种沉淀,
故答案为:生成MgCO3和Mg(OH)2两种沉淀;
Ⅱ、这两者相互促进水解反应,生成Mg(OH)2一种沉淀,则硫酸镁和碳酸镁相互促进水解生成氢氧化镁沉淀、硫酸钠和二氧化碳,反应的离子方程式为:CO32-+Mg2++H2O═Mg(OH)2↓+CO2↑,
故答案为:CO32-+Mg2++H2O═Mg(OH)2↓+CO2↑;
Ⅲ、(1)图1中装置B为干燥管,装置C中是用来验证二氧化碳气体的试剂澄清石灰水,依据是否变浑浊判断是否含有碳酸镁沉淀,
故答案为:干燥管;澄清石灰水;
(2)若假设二成立,沉淀巍峨氢氧化镁,氢氧化镁试管中加热反应生成氧化镁和水,图Ⅰ中装置B盛有无水硫酸铜,检验水的存在无水硫酸铜变蓝色证明有水生成,装置C是中澄清石灰水不变浑浊证明无二氧化碳生成,说明沉淀中无碳酸镁,所以B中无水硫酸铜变蓝色,C中澄清石灰水不变浑浊证明假设二正确,
故答案为:B中无水硫酸铜变蓝色,C中澄清石灰水不变浑浊;
(3)图II装置进行定量分析,利用排水法测定生成气体的体积,二氧化碳溶于水,为减少测定误差,广口瓶中水面上覆盖了一层植物油,这层植物油的作用是防止生成的二氧化碳溶于水减小误差,
故答案为:防止生成的二氧化碳溶于水减小误差;
(4)假设Ⅲ沉淀为氢氧化镁和碳酸镁的混合物,加入酸反应生成气体为二氧化碳,排水法测定二氧化碳体积为aL,物质的量n(CO2)=$\frac{aL}{22.4L/mol}$,结合原子守恒计算碳酸镁质量得到质量分数=$\frac{\frac{a}{22.4}mol×84g/mol}{w}$×100%,故答案为:$\frac{\frac{a}{22.4}mol×84g/mol}{w}$×100%.
点评 本题考查了物质性质的分析判断,盐类水解产物的理解应用,实验过程分析和实验步骤的判断,主要是试剂作用的分析,掌握基础是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 氢化物的稳定性Y<Z<W | |
| B. | Y的单质常用来制造光导纤维 | |
| C. | W的单质可作为水处理中的消毒剂 | |
| D. | X的最高价氧化物对应的水化物可与W的单质发生反应 |
| A.由淀粉得到的酒精,Na2S溶液中存在的HS- | 均为水解反应生成 |
| B.C+CO2=2CO,3C+SiO2=SiC+2CO | 均为碳单质只作还原剂的氧化还原反应. |
| C.由Fe生成FeCl2或FeCl3,由Na生成Na2O或Na2O2 | 均可通过化合反应实现 |
| D.乙醇使酸性KMnO4溶液褪色,SO2使滴有酚酞的NaOH溶液褪色 | 均发生氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Al3+的结构示意图: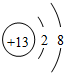 | B. | NaClO的电子式: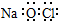 | ||
| C. | 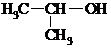 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | D. | 乙醛分子的比例模型: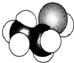 |
 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )| A. | 该电池在常温下不能正常工作 | |
| B. | 熔融NaAlCl4不参与正常电极反应 | |
| C. | 正常充电的阴极反应;NaCl+e-=Na+Cl- | |
| D. | 过放电时正极反应:AlCl${\;}_{4}^{-}$-3e-=4Cl-+Al |
| A. |  如图表示室温下,用0.1mol•L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3•H2O),虚线表示c(NH${\;}_{4}^{+}$),处于M点时溶液呈中性 | |
| B. |  如图表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. |  如图表示反应2NH3(g)?3H2(g)+N2(g),在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系 | |
| D. |  如图表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处 |
| 选项 | 操作 | 现象 | 结论 |
| A | 用玻璃杯蘸取X溶液沾到淀粉KI试纸上 | 试纸变蓝色 | X溶液可能是氯水 |
| B | 向稀HNO3和稀H2SO4中分别加入Fe粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 向酚酞溶液中加入过量的Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的 碱有漂白性 |
| D | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红 | CuO被内焰中的乙醇蒸气还原 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 室温时,NaHA溶液pH<7,是由于HA-的电离程度大于其水解程度 | |
| B. | 在0.1 mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1 mol/L | |
| C. | 在0.1 mol/L的NaHA溶液中,一定有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 向两份等体积NaHA、Na2A的浓度比为1:1的混合溶液中分别加入适当浓度的盐酸与氢氧化钠,其pH随加入酸、碱量的变化图象为: |