题目内容
16.为减少温室气体排放,人们积极寻找不含碳元素的燃料.经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景.(1)NH3中氮元素和氢元素的质量比为14:3.
(2)将NH3燃烧反应的化学方程式补充完整:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$6H2O+2N2.
分析 (1)化学式中元素质量之比等于化学式中元素原子相对原子质量之和之比;
(2)由元素守恒可知,缺项物质为氮气,根据N原子守恒确定其系数.
解答 解:(1)NH3中氮元素和氢元素的质量比为14:1×3=14:3,故答案为:14:3;
(2)由元素守恒可知,缺项物质为氮气,根据N原子守恒可知其系数为2,反应方程式为4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$6H2O+2N2,故答案为:2N2.
点评 本题考查质量分数计算、化学方程式的书写等,比较基础,有利于基础知识的巩固.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
7.能在水溶液中大量共存的一组离子是( )
| A. | H+、Fe3+、I-、SO42- | B. | Al3+、Mg2+、HCO3-、Cl- | ||
| C. | K+、Ca2+、NO3-、SiO32- | D. | K+、Na+、OH-、AlO2- |
7.紫苏醇的结构简式如图所示.下列有关紫苏醇的说法正确的是( )


| A. | 与乙醇互为同系物 | |
| B. | 一定条件下能与乙酸发生酯化反应 | |
| C. | 存在属于芳香族化合物的同分异构体 | |
| D. | 能与溴水、酸性高锰酸钾溶液发生加成反应 |
4.下表中对应关系正确的是( )
| A.由淀粉得到的酒精,Na2S溶液中存在的HS- | 均为水解反应生成 |
| B.C+CO2=2CO,3C+SiO2=SiC+2CO | 均为碳单质只作还原剂的氧化还原反应. |
| C.由Fe生成FeCl2或FeCl3,由Na生成Na2O或Na2O2 | 均可通过化合反应实现 |
| D.乙醇使酸性KMnO4溶液褪色,SO2使滴有酚酞的NaOH溶液褪色 | 均发生氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
11.下列过程中,发生了化学变化的是( )
| A. | 磨豆成浆 | B. | 剪纸成花 | C. | 酿谷成酒 | D. | 雕石成像 |
1.下列有关化学用语表示正确的是( )
| A. | Al3+的结构示意图: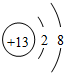 | B. | NaClO的电子式: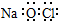 | ||
| C. | 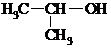 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | D. | 乙醛分子的比例模型: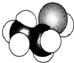 |
8. 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )| A. | 该电池在常温下不能正常工作 | |
| B. | 熔融NaAlCl4不参与正常电极反应 | |
| C. | 正常充电的阴极反应;NaCl+e-=Na+Cl- | |
| D. | 过放电时正极反应:AlCl${\;}_{4}^{-}$-3e-=4Cl-+Al |
5.下列坐标图均涉及到平衡原理,其中相关( )
| A. |  如图表示室温下,用0.1mol•L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3•H2O),虚线表示c(NH${\;}_{4}^{+}$),处于M点时溶液呈中性 | |
| B. |  如图表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. |  如图表示反应2NH3(g)?3H2(g)+N2(g),在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系 | |
| D. |  如图表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处 |
6.下列装置或操作能达到实验目的是( )
| A. | 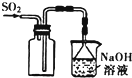 用图所示装置收集SO2气体 | |
| B. | 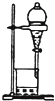 用图所示装置萃取碘水中的碘 | |
| C. | 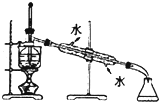 用图所示装置进行石油的分馏 | |
| D. | 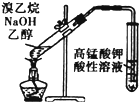 用图所示装置检验溴乙烷与NaOH乙醇溶液共热产生的乙烯 |