题目内容
【题目】氢能是理想的清洁能源。科学家通过化学方法使能量按人们所期望的形式转化,从而提高能源的利用率。
(1)氢气在燃烧时,放出大量热量,说明该反应是____反应(填“放热”或“吸热”);这是由于反应物的总能量___生成物的总能量(填“大于”或“小于”);从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量________形成产物的化学键放出的总能量(填“大于”或“小于”)。
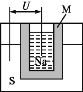
(2)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,如图就是能够实现该转化的装置,被称为氢氧燃料电池。

该电池的正极是_____(填“a电极”或“b电极”),在负极发生的电极反应式是_________________。电池反应的总方程式________________________。
【答案】放热 大于 小于 b电极 H2 2e = 2H+ 2H2+O2 =2H2O
【解析】(1)氢气在燃烧时,放出大量热量,说明该反应是放热反应;这是由于反应物的总能量大于生成物的总能量;由于断裂反应物中的化学键吸收的总能量小于形成产物的化学键放出的总能量。
(2)氢氧燃料电池,通入氢气的一极失电子发生氧化反应,通入氧气的一极得电子发生还原反应,b电极是该电池的正极,a是负极,酸性条件下,负极发生的电极反应式是H22e =2H+。电池反应的总方程式是2H2+O2 =2H2O。

【题目】温度为T时,向4L恒容密闭容器中充入2molPCl5,反应PCl5(g)PCl3(g)+Cl2(g),经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
A.反应在前50s的平均速率为v(PCl3)=0.0064mol/(Ls)
B.保持其它条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则反应的△H<0
C.相同温度下,起始时向容器中充入4molPCl3、4molCl2 , 达到平衡时,则此反应的化学平衡常数为0.025mol/L
D.相同温度下,起始时间向容器中充入2molPCl5、0.40molPCl3和0.40molCl2 , 达到平衡前v(正)<v(逆)