题目内容
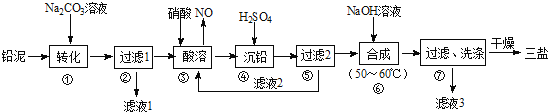
【题目】(1)工业上以粗铜为原料采取如下图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是___________________________。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在____________范围。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
不用加水的方法调节溶液pH的原因是_______________________________________。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
_________________________________________________________________________。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是______________________。
(3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是__________(填字母)。

a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3![]() NH
NH![]() +NH
+NH![]() ,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是______________________________________;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______________________________________。
,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是______________________________________;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______________________________________。
【答案】 提高原料的利用率,减少污染物的排放 3.2~4.7 加水会将溶液稀释,不利于将滤液蒸发浓缩 由于Cu2+发生水解:Cu2++2H2O![]() Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解 Cu2++2e-=Cu b d N2O4
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解 Cu2++2e-=Cu b d N2O4![]() NO++NO
NO++NO![]() Cu+2N2O4=Cu(NO3)2+2NO↑
Cu+2N2O4=Cu(NO3)2+2NO↑
【解析】(1)①氮氧化物与水和氧气发生氧化还原反应最终生成硝酸;②Fe3+易水解,为利用溶液的蒸发浓缩,应尽量用浓溶液;③从影响盐类水解平衡移动的角度分析;(2)电镀时,镀层金属做阳极,待镀物质做阴极;(4)依据2NH3![]() NH4++NH2-,类推结合题干信息写出电离方程式;从质量守恒的角度书写反应的化学方程式。
NH4++NH2-,类推结合题干信息写出电离方程式;从质量守恒的角度书写反应的化学方程式。
(1)粗铜中加入稀硝酸,Fe、Cu和稀硝酸反应生成Fe(NO3)3、Cu(NO3)2,同时生成氮氧化物,氮氧化物和水反应生成硝酸,能循环利用,调节溶液的pH,将Fe(NO3)3转化为Fe(OH)3沉淀,然后过滤得到滤渣,滤液为Cu(NO3)2溶液,向滤液中加入稀硝酸并调节溶液的pH,然后蒸发浓缩、冷却结晶、过滤洗涤得到硝酸铜晶体,①氮氧化物有毒,且NO不和水反应,通入氧气和水,氮氧化物和氧气、水反应生成硝酸,硝酸能循环利用,从而提高原料利用率,且减少污染物的排放,故答案为:将NOx转化为硝酸,提高原料的利用率,减少污染物的排放;②调节溶液的pH使氢氧化铁完全沉淀,铜离子不产生沉淀,当溶液的pH在1.9~3.2之间,铁离子沉淀,而铜离子不产生沉淀,pH为4.7时铜离子产生沉淀,所以调节溶液的pH为3.2--4.7;加水会将溶液稀释,不利于将滤液蒸发浓缩,故不用加水的方法调节溶液pH;③铜离子水解生成氢氧化铜和氢离子,水解方程式为Cu2++2H2O![]() Cu(OH)2+2H+,加入稀硝酸能抑制硝酸铜溶解;(2)工业上常利用硝酸铜溶液电镀铜,电镀时,镀层金属做阳极,待镀物质做阴极,阴极的电极反应式是:Cu2++2e-=Cu;(3)a.在溶解度曲线上方的溶液为过饱和溶液,所以A点时的溶液为饱和溶液,故错误;b.根据图象知,B点时两种晶体在水溶液中都达到饱和,所以二者可以共存,故正确;c.结晶温度较低,晶体以Cu(NO3)2·6H2O析出,故错误;d.若将C点时的溶液降温至30°C以下,如果溶液为过饱和溶液,根据图象知,可以析出Cu(NO3)2·6H2O晶体,故正确;答案选bd;(4)液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是;N2O4
Cu(OH)2+2H+,加入稀硝酸能抑制硝酸铜溶解;(2)工业上常利用硝酸铜溶液电镀铜,电镀时,镀层金属做阳极,待镀物质做阴极,阴极的电极反应式是:Cu2++2e-=Cu;(3)a.在溶解度曲线上方的溶液为过饱和溶液,所以A点时的溶液为饱和溶液,故错误;b.根据图象知,B点时两种晶体在水溶液中都达到饱和,所以二者可以共存,故正确;c.结晶温度较低,晶体以Cu(NO3)2·6H2O析出,故错误;d.若将C点时的溶液降温至30°C以下,如果溶液为过饱和溶液,根据图象知,可以析出Cu(NO3)2·6H2O晶体,故正确;答案选bd;(4)液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是;N2O4![]() NO++NO3-;Cu与液态N2O4反应制得无水硝酸铜,根据质量守恒和电子守恒可写出反应的化学方程式为Cu+2N2O4=Cu(NO3)2+2NO↑。
NO++NO3-;Cu与液态N2O4反应制得无水硝酸铜,根据质量守恒和电子守恒可写出反应的化学方程式为Cu+2N2O4=Cu(NO3)2+2NO↑。

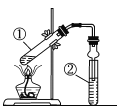
【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D