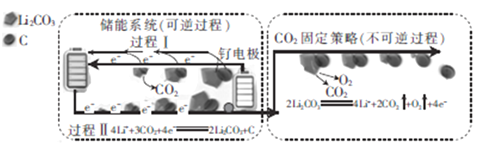
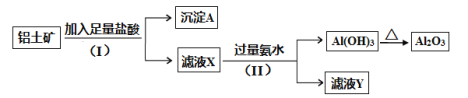
题目内容
【题目】向一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是
A.加入的碱过量
B.反应后溶液中c(A-)=c(M+)
C.混合前酸与碱中溶质的物质的量相等
D.生成的盐发生水解
【答案】B
【解析】
反应后的溶液一定呈电中性,根据电荷守恒,则有c(A-)+c(OH-)=c(M+)+c(H+),当溶液呈中性时,c(H+)=c(OH-),因此c(M+)=c(A-);若MOH为弱碱,则生成的盐能水解,此时碱一定过量;若MOH为强碱时,则生成的盐不水解,酸碱恰好反应,混合前n(HA)=n(MOH)。答案选B。

 走进文言文系列答案
走进文言文系列答案【题目】(1)工业上以粗铜为原料采取如下图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是___________________________。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在____________范围。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
不用加水的方法调节溶液pH的原因是_______________________________________。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
_________________________________________________________________________。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是______________________。
(3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是__________(填字母)。

a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3![]() NH
NH![]() +NH
+NH![]() ,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是______________________________________;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______________________________________。
,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是______________________________________;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______________________________________。
【题目】苯乙烯是重要的化工原料,可由乙烯、乙炔为原料合成。反应过程如下所示:
乙炔聚合:3C2 H2 (g)![]() C6H6 (g) H1
C6H6 (g) H1
合成乙苯:C6H6(g)+C2H4(g)![]() C6H5CH2CH3(g) H2
C6H5CH2CH3(g) H2
乙苯脱氢:C6H5CH2CH3(g)![]() C6H5CH=CH2 (g)+H2 (g) △H3
C6H5CH=CH2 (g)+H2 (g) △H3
(1)乙苯脱氢是合成苯乙烯的关键步骤。某温度下,向2.0 L恒容密闭容器中充入0.10mol C6H5CH2CH3 (g),测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①计算该温度下的平衡常数K= ______(结果保留至小数点后两位)。
②下列不能说明该温度下反应达到平衡状态的是_____(填字母代号)。
a.v(C6H5CH2CH3)=v(H2) b.苯乙烯的体积分数不变
c.平衡常数K保持不变 d.混合气体的平均相对分子质量不变
(2)向体积为3.0 L的恒容密闭容器中充入0. 20 mol C6H5CH2CH3(g),当乙苯脱氢反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。

①该反应的H3______0(填“大于”“等于”或“小于”)。
②该平衡体系在600℃时,乙苯的物质的量分数为50%,则氢气的物质的量分数为_____。若在此温度下加入水蒸气作稀释剂,则乙苯的平衡转化率将如何变化并简述理由__________。
(3)苯乙烯能与酸性KMnO4溶液混合反应生成苯甲酸(C6H5COOH)。室温下,向饱和苯甲酸溶液中加入碳酸氢钠固体使溶液显中性,则溶液中c(C6H5COOH):c(C6H5COO-)=___________。(已知:苯甲酸的Ka=6.4×l0-5;碳酸的Kal=4.2×l0-7,Ka2=5.6×l0-ll)