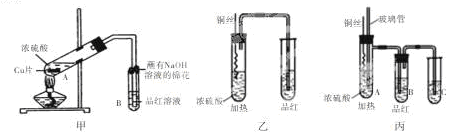
题目内容
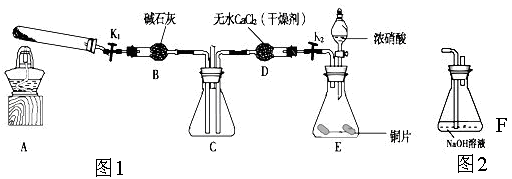
下图是一位学生设计的实验室制取和收集氯气并验证其性质的装置图。
(1)找出在此装置图中出现的错误加以改正。
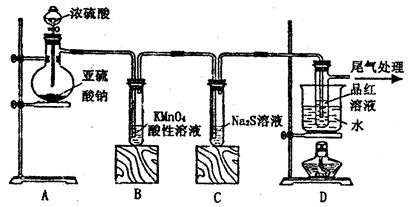
(2)实验过程中,在D装置中观察到的实验现象是 ;在E装置中观察到的实验现象是 ,反应的化学方程式是 ;
(3)F装置的作用是 ,反应的离子方程式是 。
(1)稀盐酸改用浓盐酸。B应在A的左边。C中进气管应该长,排气管应该短。(每空1分,共3分。)
(2)溶液先变红后褪色;(2分) 有白色沉淀生成,Cl2+H2O =HClO +HCl
HCl+AgNO3=AgCl↓ +HNO3(每个答案1分,共3分。写总反应、写离子方程式都可)。
(3)吸收多余的氯气,防止污染环境,(1分) Cl2+2OH—=ClO—+Cl—+H2O(2分)
解析试题分析:(1)观察装置图中试剂和仪器,出现的错误有:制取Cl2反应物为MnO2和浓盐酸,把装置图中的稀盐酸改为浓盐酸;应先用饱和食盐水除去HCl,再用浓硫酸除去H2O,所以B应在A的左边;Cl2的密度大于空气,收集时进气管应该长,排气管应该短。
(2)Cl2通入石蕊溶液,酸性使石蕊变化,Cl2与H2O反应生成的HClO具有漂白性,使石蕊褪色;Cl2与H2O反应生成的HCl与AgNO3反应生成白色AgCl沉淀,化学方程式有2个,首先是Cl2与H2O反应生成HCl和HClO,然后是HCl与AgNO3反应生成AgCl沉淀和HNO3。
(3)NaOH能与Cl2反应,所以NaOH溶液的作用是吸收多余的氯气,防止污染环境;Cl2与OH?反应生成Cl?、ClO?和H2O,配平可得离子方程式。
考点:本题考查Cl2实验室制法的实验仪器和试剂及作用、实验现象的观察、方程式的书写。

 名校课堂系列答案
名校课堂系列答案某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。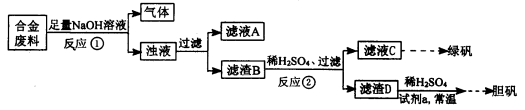
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,标况) | 1.12 | 2.24 | 3.36 | 4.48 |
②滤渣B中Fe的质量分数为____%(精确到0.1%)。
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X是①Na2CO3溶液和稀盐酸 ②Cl2和Fe ③C和O2 ④SO2和NaOH溶液 ⑤AlCl3溶液和NaOH溶液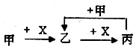
| A.①②③④均可以 | B.②③④⑤均可以 |
| C.①②③⑤ 均可以 | D.①②③④⑤均可以 |


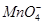 +□H2O=□
+□H2O=□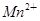 +□
+□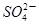 +□H+;
+□H+;
 的物质的量浓度变化趋势为 ;
的物质的量浓度变化趋势为 ; 外,还存在另一种浓度较大的阴离子。为检验该阴离子,先取固体试样溶于水配成溶液。以下是检验该阴离子的两种实验方案你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
外,还存在另一种浓度较大的阴离子。为检验该阴离子,先取固体试样溶于水配成溶液。以下是检验该阴离子的两种实验方案你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。 ,再加
,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。 固体加热到600℃以上分解的化学方程式 。
固体加热到600℃以上分解的化学方程式 。